- Home
- Diergezondheid
- Dierziekten
- Venezuelan-Equine-Encephalomyelitis
Venezuelan Equine Encephalomyelitis
Venezuelan Equine Encephalomyelitis (VEE) is een ziekte die sporadisch maar soms epizoötisch optreedt bij paarden en mensen, en die wordt overgebracht door muggen. VEEV is voor wat betreft de ernst van de ziekteverschijnselen een van de belangrijkste humane en veterinaire pathogenen in Zuid- en Midden-Amerika. Knaagdieren en buideldieren zijn tussengastheer, maar sommige subtypes van het virus kunnen ook circuleren en amplificeren in paarden. Mensen zijn eindgastheer van dit virus, paarden zijn voor de meeste subtypes (de zogenaamde enzoötische virussen) eindgastheer, terwijl ze voor bepaalde subtypes tussengastheer zijn. De ziekte wordt gekenmerkt door koorts, anorexia en soms ernstige depressie en diverse andere neurologische verschijnselen. Mensen zijn zeer gevoelig voor VEE en ontwikkelen na infectie meestal milde klinische verschijnselen. Epizoötische VEE-virussen kunnen ernstige neurologische verschijnselen bij paarden geven die lijken op de verschijnselen van Eastern Equine Encephalomyelitis (EEE) en Western Equine Encephalomyelitis (WEE). Infecties met enzoötische VEE-virussen verlopen over het algemeen subklinisch of geven alleen milde klinische verschijnselen. VEE komt ook nu nog regelmatig voor bij paarden en uitbraken blijven optreden in Chiapas en Oaxaca, Mexico, en in Venezuela en Colombia, vaak ook door de lage vaccinatiegraad van paarden in Zuid en Midden Amerika. Er zijn goede vooruitzichten op nieuwe genetisch gemodificeerde vaccins die zowel veilig zijn als een verhoogde effectiviteit hebben.
Veterinair kennisdossier Venezuelan Equine Encephalomyelitis
- Verschijnselen
- Diagnose
- Prevalentie
- Aanpak besmette bedrijven
- Preventie
- Regelgeving
- Websites en literatuur
De kiem
VEE wordt veroorzaakt door een virus van het geslacht Alphavirus van de familie van de Togavirussen. Het Venezuelan Equine Encephalomyelitis Viruscomplex (VEEV) bestaat uit minstens 6 verschillende subtypes, I tot VI. VEEV subtype I is weer onder te verdelen in vijf antigene varianten of serovars: IAB, IC, ID, IE en IF. De epizoötische virussen behoren tot subtype IAB en I-C, de enzoötische virussen tot subtype ID, IE, IF en de overige subtypes. Bij de overgang van een enzoötische naar een epizoötische cyclus spelen altijd meerdere factoren een rol: 1) mutaties richting meer pathogene stamen (een enkele mutatie in een base paar kan het subtype ID al veranderen in een meer pathogeen subtype IAB of IC); 2) een verandering in reservoir-gastheer; 3) een verandering in muggenvector. De virussen circuleren tussen knaagdieren, buideldieren, sommige vogelsoorten, voor de epidemische subtypen tussen paarden en muggen van midzomer tot laat in de herfst. VEEV kan worden geïsoleerd uit de hersenen van gestorven paarden, met name als er minder dan 5 dagen zijn verlopen tussen de eerste verschijnselen en de sterfte. Daarnaast kunnen de epizoötische VEEV-stammen ook uit bloed, cerebrospinale vloeistof en keelswabs geïsoleerd worden.

Gevoelige diersoorten
Enzoötische VEEV-stammen circuleren normaliter tussen muggen van het genus Culex en in het wild voorkomende knaagdieren of buideldieren. In sommige cycli zijn ook vogels betrokken. Paarden en mensen vormen de eindgastheren voor de enzoötische subtypes. De natuurlijke gastheer voor epizoötische VEEV-stammen is eigenlijk onbekend. Paarden zijn het belangrijkste reservoir tijdens uitbraken. Veel soorten muggen en bloedzuigende en stekende insecten kunnen deze VEEV-stammen overdragen. Mechanische transmissie door steekvliegen, mijten en teken is ook beschreven. Alhoewel paarden epizoötische VEEV-stammen ook met excreta en secreta kunnen uitscheiden, vindt directe transmissie niet of nauwelijks plaats, alleen door laboratoriumincidenten zijn wel humane infecties voorgekomen. Epizoötische VEEV-stammen kunnen ernstige ziekte veroorzaken bij paarden, muildieren, ezels en zebra’s. Ook is tijdens dergelijke uitbraken sterfte gerapporteerd bij konijnen, honden, geiten en schapen. Runderen, varkens, vleermuizen en opossums kunnen ook geïnfecteerd worden.
Volksgezondheid
Mensen zijn evenals paarden gevoelig voor infectie met VEEV. De incubatieperiode van VEE is 1 tot 6 dagen. Bij mensen is VEE meestal een acute, meestal mild verlopende, systemische ziekte met koorts, rillingen, malaise, ernstige hoofdpijn, spierpijn en soms hoesten, keelpijn, misselijkheid, braken en diarree. Ongeveer 4% van de geïnfecteerde kinderen ontwikkelt een milde tot ernstige encephalitis. Neurologische symptomen komen slechts bij 1% van de geïnfecteerde volwassenen voor. Bij zwangere vrouwen kan het virus de placenta passeren en voor abortus, doodgeboorte en congenitale afwijkingen zorgen. Ernstige infecties en sterfte zijn gevonden bij laboratoriummedewerkers. Daarom dient werk aan deze virussen uitsluitend in laboratoria met isolatieniveau 3 te geschieden.
Overleving
VEEV kan uitgescheiden worden en in opgedroogd bloed en exsudaten/secreta gevonden worden. Er zijn geen harde data bekend over de duur van overleving in de omgeving.
Desinfectie
VEEV is gevoelig voor de meeste gebruikelijke desinfectantia (Na Chloriet, Halamid, formaline, ethanol, glutaaraldehyde). Het virus is gevoelig voor vochtige en droge verhitting en voor droogte. Recente studies hebben aangetoond dat RNA fragmentatie en cDNA synthese betrouwbare methoden zijn voor het inactiveren van monsters die genomen bevatten van equine encephalitis virussen (WEEV, VEEV en EEEV).
Verschijnselen van Venezuelan Equine Encephalomyelitis
Klinisch beeld
Enzoötische VEEV-stammen veroorzaken meestal subklinische infecties bij paarden met soms slechts milde symptomen. Epizoötische VEEV-stammen geven vergelijkbare neurologische syndromen als EEE en WEE. Bij paarden zijn de meest kenmerkende neurologische verschijnselen excitatie, blindheid, ataxie, ernstige mentale depressie, verlamming, krampen en sterfte. Er komen echter ook ziekteverschijnselen als koorts, slapheid, depressie, gebrek aan eetlust, koliek en diarree voor zonder neurologische verschijnselen. Ook komen asymptomatische infecties voor.
Een voorlopige waarschijnlijkheidsdiagnose kan worden gesteld indien niet gevaccineerde paarden de karakteristieke slaperigheid vertonen gedurende de zomer in gematigde klimaatzones of gedurende het regenseizoen in tropische en subtropische regio’s. Echter: andere door muggen overgebrachte ziekten zoals West Nile Fever geven dezelfde klinische verschijnselen.
Morbiditeit/mortaliteit
VEE-epidemieën beginnen normaliter bij paarden, waarbij de eerste humane gevallen zich weken later voordoen. VEE-epidemieën kunnen jaren aanhouden. Tot 90% van de paarden kan geïnfecteerd raken tijdens een epidemie, met een morbiditeit die varieert tussen 10 en 100%. Bij paarden met neurologische verschijnselen is de case fatality ratio 40-90 procent.
De meeste enzoötische VEEV-subtypes resulteren niet in ernstige ziekte of sterfte bij paarden, maar voor sommige varianten zijn beperkte uitbraken van encephalitis gerapporteerd.
Uitscheiding van de kiem
Bij mensen is er geen sprake van uitscheiding. Paarden kunnen epizoötische VEEV-stammen wel uitscheiden, waarbij echter niet of nauwelijks transmissie plaatsvindt. Besmetting van mensen en paarden vindt plaats door muggen of andere insecten (mechanische transmissie) die bij paarden (alleen voor epizoötische VEEV-stammen), knaagdieren of buideldieren hun bloedmaal hebben opgenomen.
Differentiaaldiagnostiek
Zonder diagnostische testen is geen onderscheid te maken met West Nile Virus. Omdat geen enkel verschijnsel specifiek is, komen veel ziekten in aanmerking zoals EEE en WEE, West Nile Fever, Afrikaanse Paardenpest, Rabiës, Infectieuze Anemie, Equine Herpesvirus Myeloencephalopathie (EHM), in Amerika Equine Protozoal Myeloencephalitis (EPM), vermineuze encephalopathie, neuroborreliose, cervicale vertebrale stenose, diverse vergiftigingen, botulisme, leverkolder en trauma.

Diagnostiek van Venezuelan Equine Encephalomyelitis
Pathologie
Grove pathologische laesies ontbreken vaak bij paarden. Hoogstens zijn congesties van de hersenen en meningen te zien. Eventueel worden bloedingen door trauma waargenomen. Microscopische laesies worden gewoonlijk wel aangetroffen in het gehele zenuwstelsel en zijn van diagnostische waarde. Er is een wijdverspreide ontstekingsreactie in de grijze hersensubstantie. Degeneratie en necrose van neuronen met gliosis en infiltratie van ontstekingscellen treedt vaak op. Perivasculaire ophopingen van lymfocyten en neutrofielen zijn te zien. De ernst van de infectie en de duur van de neurologische verschijnselen zijn geassocieerd met de mate en plaats van voorkomen van laesies. VEEV kan via immunohistochemie, maar ook via in situ hybridisatie of RT-PCR, rechtstreeks op hersenmateriaal worden aangetoond.
Isolatie van de kiem
VEEV kan vaak worden geïsoleerd uit het bloed van paarden tijdens de vroege koortsfase van de ziekte. Wanneer er neurologische verschijnselen optreden zijn de paarden over het algemeen niet viremisch meer. Het virus kan ook geïsoleerd worden uit de hersenen van gestorven paarden of uit andere weefsels zoals de pancreas. Als de neurologische verschijnselen al langere tijd bestaan, is het vaak moeilijk om nog virus te isoleren vanuit de hersenen. Op zich zijn diverse kweeksystemen geschikt (Vero, BHK-21, RK-13, geëmbryoneerde kippeneieren, fibroblasten van kippen- en eendenembryo’s, cavia’s, hamsters, muizen). Materiaal moet binnen 48 uur na gekoelde bewaring worden onderzocht. Anders dient het materiaal te worden ingevroren en onder droog ijs te worden verzonden. Vriezen verkleint echter de kans op virusisolatie aanzienlijk. Er bestaat een groot gevaar op humane infectie bij de isolatie van virus uit besmette vogels door aërosolvorming van uiterst infectieus virus, maar voor de epidemische subtypen zijn ook paarden virus reservoir en dienen als zodanig behandeld te worden bij sectie en monstername. VEEV in muggen en weefsels kan worden aangetoond met een RT-PCR. Recent werd een Taqman kwantitatieve real-time RT-PCR beschreven voor de specifieke detectie en differentiatie van alle VEEV subtypes (Vina-Rodriguez et al. 2016). In landen zonder de faciliteiten voor virusisolatie of PCR kan ook een ELISA worden gebruikt voor het vaststellen van de besmettingsgraad in muggen.
Serologie
Voor het aantonen van antistoffen zijn de CBR, de haemagglutinatie-reductietest (HI-test), een IgM capture ELISA en een Plaque Reductie Neutralisatie Test (PRN-test) beschikbaar. De IgM capture ELISA kan naast serum ook op CSF gebruikt worden, maar dit geeft bij paarden minder consistente resultaten dan in serum (dit in tegenstelling tot de humane diagnostiek). VEE-infecties kunnen worden aangetoond in gepaarde sera, genomen met 10 tot 14 dagen tussentijd. Een viervoudige titerstijging is vereist voor het stellen van de diagnose. Meestal hebben paarden met klinische verschijnselen zeer hoge titers tegen VEEV. Detectie van IgM met een capture enzyme ELISA geeft een snelle voorlopige diagnose bij een acute infectie. De PRN-test, of de combinatie van de PRN-test met de HI-test, is het betrouwbaarst voor het aantonen van antistoffen. Er bestaan kruisreacties tussen antilichamen tegen VEEV, WEEV en EEEV bij de CBR- en de HI-testen. De PRN-test is het meest specifiek en kan gebruikt worden om onderscheid te maken tussen antistoffen gericht tegen de verschillende VEEV-subtypes.
Prevalentie van Venezuelan Equine Encephalomyelitis
Nederland
VEE komt in Nederland niet voor.
Andere landen
Europa
VEE komt niet voor in Europa.
Landen buiten Europa
Epizoötische VEEV-stammen (VEEV I-AB en I-C) komen voor in Zuid-Amerika en Centraal-Amerika. De meeste VEE-epidemieën komen voor in het noorden en westen van Zuid-Amerika, met zo nu en dan introducties in Mexico en de zuidelijke staten van de USA. VEE komt ook nu nog regelmatig voor bij paarden en uitbraken blijven optreden in Chiapas en Oaxaca, Mexico, en in Venezuela en Colombia. Eind 2016 werd er nog een VEE epidemie in Colombia gerapporteerd met 13 verschillende foci, leidend tot een forse vaccinatiecampagne. Enzoötische VEEV-stammen zijn gevonden in Mexico, delen van de USA en in Zuid- en Midden-Amerika. Voor gedetailleerde informatie over de verspreiding zie: OIE: World Animal Health Situation en OIE bulletin (www.oie.int).
Aanpak besmette bedrijven
Er zijn in de USA diverse goede vaccins voor paarden beschikbaar. Met een goed vaccinatieschema is WEE bij paarden volledig te voorkomen. Fokmerries moeten een maand voor het veulenen worden gevaccineerd om een adequate overdracht van maternale antistoffen te realiseren. Veulens uit goed gevaccineerde merries moeten vervolgens op een leeftijd van 6, 7, en 9 maanden gevaccineerd worden. Indien de merrie niet is gevaccineerd dient dit al op 4, 5 en 7 maanden te geschieden. Vervolgens moeten in endemische gebieden paarden na de veulenvaccinaties drie keer paar jaar gevaccineerd worden met intervallen van 4 maanden. Vanaf een leeftijd van vier jaar kan vervolgens volstaan worden met twee keer per jaar vaccineren. De meeste vaccins zijn geïnactiveerde volvirusvaccins die tijdig moeten worden toegediend (starten met een basisimmunisatie van twee vaccinaties). Vaak betreft het combinatievaccins voor EEE, WEE en VEE. Er zijn geen humane vaccins geregistreerd. Wel worden er in de USA bepaalde groepen militairen en laboratoriumpersoneel gevaccineerd met een experimenteel vaccin. Deze vaccins geven een acceptabele antistofrespons gecorreleerd met bescherming.
Vaccinatie van paarden is gebleken zeer effectief te zijn als aanvulling op andere controlemaatregelen, met name bij epidemieën omdat paarden daarbij als amplificatiegastheer en reservoir voor muggen optreden. Er wordt veel onderzoek verricht naar nieuwe VEE-vaccins. Recent is een genetisch gemodificeerd (deletiemutant) levend vaccin, V3526, in paarden getest waarbij 100 procent klinische effectiviteit gescoord werd na een challenge met 104 pfu virus. Daarnaast, en nog meer van belang, werd viraemie volledig voorkomen!
Er is tevens in Zuid- en Noord-Amerika een gemodificeerd levend vaccin op de markt gebracht (VEETC-83) dat gebaseerd is op een VEEV-stam afkomstig van ezels uit Trinidad (subtype IAB TrD). Dit TC-83 vaccin induceert een beschermende en langdurige immuniteit bij paarden, maar kan ook negatieve effecten veroorzaken. Bijna 40 procent van de gevaccineerde mensen vertoonde ziekteverschijnselen en vanwege deze residuele neurovirulentie is dit vaccin niet meer toegestaan in de USA. Desalniettemin wordt het in Mexico nog steeds gebruikt. Ook wordt er hard gewerkt aan nieuwe vaccins zoals MVA vector vaccins en DNA vaccins, waarbij goede bescherming in muizen gerapporteerd wordt. De stap naar humane studies moet echter nog gemaakt worden.
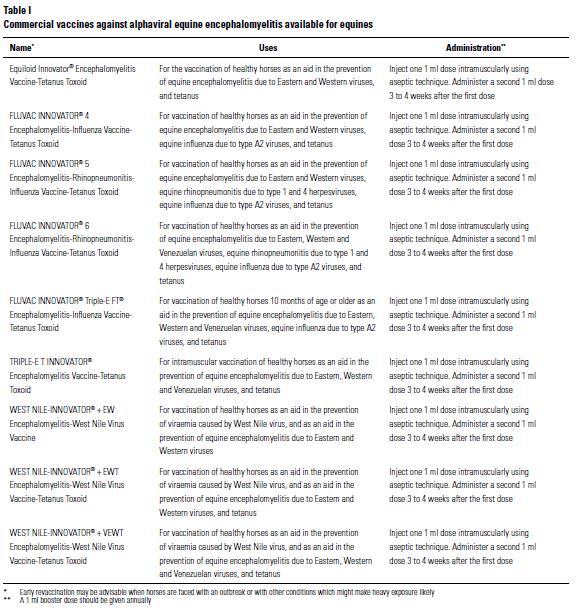
Zie verder onderstaande tabel voor commerciele vaccins voor de diverse veroorzakers van equine encephalomyelitis bij paarden.
Antibiotica/therapie
Er is geen specifieke behandeling. De behandeling van neurologische patiënten bestaat uit ondersteunende therapie met goede verzorging, NSAIDs, zo nodig infusen en electrolyten en anti-epileptica. Er zijn geen specifieke virostatica met een bewezen werking tegen VEE-infecties bij het paard. Hu et al. rapporteerden echter veelbelovende resultaten voor sorafenib. Dit voor andere doeleinden door de FDA goedgekeurde geneesmiddel bleek zowel de replicatie van VEEV als EEEV effectief te remmen, waarschijnlijk door het remmen van de translatie door defosforylering van verschillende essentiele virale eiwitten. Recent werden veelbelovende resultaten gepubliceerd voor mifepristone analogen met versterkte antivirale eigenschappen zonder toename in toxiciteit. Ook lijkt de antistof respons na VEEV infectie deels beschermend te zijn (partiële immuniteit gebaseerd op antistoffen opgewekt door eerdere infecties) en zou VEEV-specifieke antistof therapie in bepaalde situaties nuttig kunnen zijn. Recente studies in muizen hebben laten zien dat VEEV specifiek hyperimmuunserum een deel van de muizen beschermde tegen een lethale intranasale VEEV infectie. Een studie in niet-humane primaten (makaken) toonde aan dat gehumaniseerde versies van neutralizerende monoclonale antistoffen toegediend 48 uur na besmetting de dieren konden beschermen tegen ernstige VEE verschijnselen.
In een recente studie van Haese et al. werd aangetoond dat quinolinone verbindingen beschermend werken tegen door VEEV geinduceerde cytopathische effecten. Analyse van virale replicatie in cellen leidde tot de identificatie van verscheidene quinolinone verbindingen met een sterke remmende activiteit tegen VEEV vaccin- en veldstammen.
Overige maatregelen
Bescherming van paarden
Met epizoötische VEE-stammen besmette paarden kunnen indirect infectieus zijn voor de omgeving, aangezien ze als reservoir voor vector-borne transmissie dienen. Paardenvliegendekens geïmpregneerd met permetrin kunnen de infectieoverdracht door muggen beperken. Ventilatoren in de stallen verlagen de muggendruk, evenals het bespuiten van de stalmuren met insecticiden. Opstallen kan het beste plaatsvinden voordat de schemering invalt en gedurende de nacht. De muggenactiviteit is het hoogst tussen zonsondergang en zonsopgang.
Algemene maatregelen
De hoogste veiligheidseisen met betrekking tot laboratoriummedewerkers zijn geboden (niveau 3 biosecurity). Naast vaccinaties van eerder genoemde categorieen personen zijn quarantainemaatregelen nodig, samen met een onderzoek naar de verspreiding. Voor dit laatste is onderzoek nodig van zowel de muggen als het bloed van de paarden in de omgeving.
Maatregelen in het kader van de volksgezondheid
Als dit virus in Nederland geintroduceerd zou worden zijn communicatie en publieksvoorlichting van groot belang. Deze communicatie dient zich te richten op algemene maatregelen ter voorkoming van vector-overdraagbare (in dit geval door muggen overdraagbare) ziekten. Deze adviezen zullen met name betrekking moeten hebben op het reduceren van muggenpopulaties door het weghalen van alle bronnen met stilstaand water in en om het huis, het dragen van bedekkende kleding, het gebruik van repellents zoals Deet en eventueel het gebruik van muskietennetten/klamboes en insecticiden in de directe omgeving (voor zover toegestaan binnen de Nederlandse wetgeving).
Preventie
Bedrijfshygiëne/insleeppreventie
Muggenbestrijding is in de praktijk moeilijk uitvoerbaar. Een aantal praktisch uitvoerbare (preventieve) maatregelen in de directe omgeving van mens en dier is behandeld in hoofdstuk 5.
Vaccinatie
Voor paarden zijn vaccins beschikbaar. In hoeverre deze in Nederland zullen mogen worden toegepast is onduidelijk.
Regelgeving
Nederlands recht
VEE is in Nederland volgens de Europese Diergezondheids Verordening (AHR)een aangifteplichtige ziekte.
Europees recht
VEE is een meldingsplichtige ziekte volgens de Europese diergezondheidsverordening (Animal Health Regulation AHR). Vanaf 21 april 2021 valt het voorkomen en bestrijden van dierziekten namelijk onder deze verordening. VEE valt in de categorieën D+E.
De dierziekten in de Europese Diergezondheidsverordening zijn ingedeeld in de vijf categorieën A, B, C, D en E. Voor alle ziekten uit deze categorieën geldt een meldingsplicht, voor de ziekten uit categorieën A en B geldt daarnaast ook een bestrijdingsplicht.
- Dierziekten van categorie A zijn ziekten die niet in de Europese Unie voorkomen en die lidstaten meteen moeten uitroeien. Bijvoorbeeld mond-en-klauwzeer en varkenspest. Lidstaten moeten deze ziekten snel opsporen, direct bestrijden en besmette bedrijven en de directe omgeving afsluiten.
- Dierziekten van categorie B zijn ziekten die de Europese Unie wil uitroeien. Bijvoorbeeld tuberculose bij koeien, stieren en buffels. Lidstaten moeten deze ziekten daarom verplicht bestrijden. Lidstaten waar de ziekte niet voorkomt moeten maatregelen nemen om vrij te blijven van de ziekte.
- Dierziekten van categorie C zijn ziekten die minder besmettelijk zijn en die de Europese Unie wil indammen. Bijvoorbeeld de ziekte van Aujesky bij varkens en koeiengriep bij runderen. Lidstaten bepalen zelf of ze de ziekte willen uitroeien en of ze bij een uitbraak bedrijven afsluiten om verdere verspreiding te voorkomen.
- Dierziekten van categorie D zijn dierziekten die zich via internationale handelaren, vervoerders of reizigers verspreiden en die de Europese Unie wil indammen. Bijvoorbeeld abortus blauw bij varkens en verkoudheid (mycoplasma) bij kippen. Landen moeten voldoen aan Europese regels voor vervoer van en naar de EU en erbinnen.
- Dierziekten van categorie E zijn dierziekten die in de gaten gehouden moeten worden. Bijvoorbeeld Q-koorts bij geiten en paratuberculose bij runderen. Lidstaten moeten zich houden aan Europese regels om deze ziekten te melden.
VEEV komt voor op de lijst van ‘goederen’ die zijn opgenomen in bijlage I bij Besluit 1999/193/GBVB van de Raad van 9 maart 1999 tot wijziging van Besluit 94/942/GBVB betreffende het Gemeenschappelijk optreden. Dit is door de Raad vastgesteld op grond van artikel J.3 van het Verdrag betreffende de Europese Unie, ten aanzien van de controle op de uitvoer van goederen voor tweeërlei gebruik.
Internationaal
Het verkeer van paarden binnen de EU en de invoer van paarden vanuit derde landen is geregeld in Richtlijn 90/426/EEG van de Raad van 26 juni 1990 tot vaststelling van veterinairrechtelijke voorschriften voor het verkeer van paardachtigen en de invoer van paardachtigen uit derde landen. Hierin staan alleen specifieke bepalingen voor Afrikaanse paardenpest, VEE, Dourine en kwade droes genoemd, zoals hieronder aangegeven. Wel kunnen volgens artikel 13 lid 2b aanvullende waarborgen geëist worden voor ziekten die in de Gemeenschap exotisch zijn.
Artikel 13 1. De paardachtigen moeten afkomstig zijn uit derde landen:
- welke vrij zijn van paardenpest;
- welke sedert twee jaar vrij zijn van Venezolaanse paardenencefalomyelitis (VEE);
- welke sedert zes maanden vrij zijn van dourine en van kwade droes.
2. Volgens de procedure van artikel 24 kan de Commissie
- beslissen dat lid 1 slechts voor een gedeelte van het grondgebied van een derde land geldt. In geval van regionalisering van de vereisten ten aanzien van paardenpest dienen ten minste de in artikel 5, leden 2 en 3, genoemde maatregelen in acht te worden genomen;
- aanvullende waarborgen eisen voor ziekten die in de Gemeenschap exotisch zijn.
Websites en literatuur
Websites
- www.oie.int
- www.ec.europa.eu
- www.rijksoverheid.nl/ministeries/ez/
- www.nvwa.nl
- www.dierengezondheidszorg.be
- www.wur.nl
- www.defra.gov.uk/animal-diseases/
- http://www.fao.org/
- http://www.ec.europa.eu/
- http://www.cfsph.iastate.edu/
- http://www.vet.uga.edu/vpp/gray_book/fad/cbp.php
Literatuur
- Acha PN, Szyfres B [Pan American Health Organization (PAHO)]. Zoonoses and communicable diseases common to man and animals. Volume 2. Chlamydioses, rickettsioses, and viroses. 3rd ed. Washington DC: PAHO; 2003. Scientific and Technical Publication No. 580. Venezuelan equine encephalitis; p. 333-345.
- Aréchiga-Ceballos N, Aguilar-Setién A. Alphaviral equine encephalomyelitis (Easter, Western and Venezuelan). Rev Sci Tech Off Int Epiz 2015; 34 (2): 491-501
- Calisher CH. Medically important arboviruses of the United States and Canada. Clin Microbiol Rev. 1994;7:89-116.
- Centers for Disease Control and Prevention (CDC). Information on arboviral encephalitides [online]. CDC; 2005 Nov. Available at: http://www.cdc.gov/ncidod/dvbid/arbor/arbdet.htm.
- Chin J, editor. Control of communicable diseases. Washington, D.C.: American Public Health Association; 2000. Arthropod–borne viral diseases; p. 28-47.
- Dupuy LC, Richards MJ, Livingston BD, Hannaman D, Schmaljohn CS. A Multiagent Alphavirus DNA Vaccine Delivered by Intramuscular Electroporation Elicits Robust and Durable Virus-Specific Immune Responses in Mice and Rabbits and Completely Protects Mice against Lethal Venezuelan, Western, and Eastern Equine Encephalitis Virus Aerosol Challenges. J Immunol Res. 2018 Jun 3;2018.
- Forrester et al. Evolution and spread of Venezuelan equine encephalitis complex alphavirus in the Americas. PLOS Neglected Tropical Diseases August 2017: 1-19.
- Garner G, Saville P, Fediaevsky A. Manual for the Recognition of Exotic Diseases of Livestock: A Reference Guide for Animal Health Staff [online]. Food and Agriculture Organization of the United Nations [FAO]; 2004. Equine viral encephalomyelitis. Available at: http://www.spc.int/rahs/. Accessed 4 Apr 2008.
- Haese NN, May NA, Taft-Benz S, et al. Identification of Quinolinones as Antivirals against Venezuelan Equine Encephalitis Virus. Antimicrob Agents Chemother. 2021 Aug 17;65(9)Hu WG, Steigerwald R, Kalla M, Volkmann A, Noll D, Nagata LP. Protective efficacy of monovalent and trivalent recombinant MVA-based vaccines against three encephalitic alphaviruses. Vaccine. 2018 Aug 16;36(34):5194-5203.
- Kahn CM, Line S, editors. The Merck veterinary manual [online]. Whitehouse Station, NJ: Merck and Co; 2003. Equine encephalomyelitis. Available at: http://www.merckvetmanual.com/mvm/index.jsp?cfile=htm/bc/100900.htm.
- Leake CJ. Mosquito–borne arboviruses. In: Palmer SR, Soulsby EJL, Simpson DIH, editors. Zoonoses: Biology, clinical practice and public health control. New York: Oxford University Press; 1998. p.401–413.
- Long MT. West Nile Virus and Equine Encephalitis Viruses – New Perspectives. Vet Clin Equine 2014; 30: 523-542.
- Lundberg L, Brahms A, Hooper I, Carey B, Lin SC, Dahal B, Narayanan A, Kehn-Hall K. Repurposed FDA-Approved drug sorafenib reduces replication of Venezuelan equine encephalitis virus and other alphaviruses. Antiviral Res. 2018 Sep;157:57-67.
- Public Health Agency of Canada, Office of Laboratory Security. Material Safety Data Sheet: Venezuelan equine encephalitis virus, Eastern equine encephalitis virus [online]. Office of Laboratory Security; 2001 Jan. Available at: http://www.phac-aspc.gc.ca/msds-ftss/msds162e.html.
- Schmaljohn AL, McClain D. Alphaviruses (Togaviridae) and flaviviruses (Flaviviridae). In: Baron S, editor. Medical microbiology [online]. 4th ed. New York: Churchill Livingstone; 1996. Available at: http://www.gsbs.utmb.edu/microbook/ch054.htm.
- Kortepeter M, Christopher G, Cieslak T, Culpepper R, Darling R, Pavlin J, Rowe J, McKee K, Eitzen E, editors. Medical management of biological casualties handbook [online]. 4th ed. United States Department of Defense; 2001. Venezuelan equine encephalitis. Available at: http://www.vnh.org/BIOCASU/14.html.* Accessed 10 Dec 2002.
- U.S. Department of Agriculture, Animal and Plant Health Inspection Service [USDA APHIS]. Venezuelan equine encephalomyelitis [online]. APHIS; 2002 Sept. Available at: http://www.aphis.usda.gov:80/oa/pubs/fsvee.html.
- Vina-Rodriguez A, Eiden M, Keller M, Hinrichs W, Groschup MH. A quantitative real-time RT-PCR for the detection of Venezuelan equine encephalitis virus utilizing a universal alphavirus control RNA. Biomed Res Int 2016; 8543204
- Walton TE. Venezuelan equine encephalomyelitis. In: Foreign animal diseases. Richmond, VA: United States Animal Health Association, 1998. Available at: http://www.vet.uga.edu/vpp/gray_book02/fad/vee.php. Accessed 4 Aor 2008.
- Weaver SC, Ferro C, Barrera R, Boshell J, Navarro JC. Venezuelan equine encephalitis. Annu Rev Entomol. 2004;49:141-74.
- World Organization for Animal Health [OIE] . Manual of diagnostic tests and vaccines for terrestrial animals [online]. Paris: OIE; 2008. Venezuelan equine encephalomyelitis. Available at: http://www.oie.int/en/manual-of-diagnostic-tests-and-vaccines-for-terrestrial-animals/