- Home
- Diergezondheid
- Dierziekten
- Newcastle-Disease
Newcastle Disease
Newcastle Disease (NCD), ook wel pseudovogelpest genoemd, is een zeer besmettelijke virusziekte die gepaard kan gaan met:
- ademhalingsproblemen;
- darmproblemen
- eiproductiedaling;
- nerveuze symptomen;
- sterfte bij kippen, kalkoenen en andere hoenderachtigen.
Vele vogelsoorten kunnen virusdragers zijn, het virus verspreiden en ziek worden. De ziekte komt wereldwijd voor en is bekend sinds 1926. In de Europese Diergezondheidsverordening (EU) 2016/429 is NCD aangemerkt als categorie A-ziekte, dat wil zeggen dat het een bestrijdingsplichtige dierziekte is. NCD is meldingsplichtig op basis van artikel 2.12 en 5.3 van de Wet dieren. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA. Verplichtingen rondom vaccinatie van bedrijfsmatig pluimvee en het tentoonstellen van pluimvee, loopvogels en postduiven zijn vastgelegd in de Regeling houders van dieren.
Veterinair kennisdossier Newcastle Disease
Het virus
Het NCD-virus wordt veroorzaakt door het avian orthoavulavirus 1, ook wel bekend als aviair paramyxovirus type 1 (APMV-1). De naam aviair paramyxovirus is officieel verouderd, maar algemeen bekend. Om deze reden blijven we in dit veterinaire dossier over APMV spreken in plaats van avian orthoavulavirus 1.
- Orde: Mononegavirales
- Familie: Paramyxoviridae
- Subfamilie: Avulavirinae
- Genus: Orthoavulavirus
Binnen de aviaire paramyxovirussen (APMV’s) vallen twintig verschillende serotypen. Serotype 1 (APMV-1) is het meest relevant voor pluimvee en de virulente (mesogene of velogene) stammen hiervan zijn gedefinieerd als NCD. Bekend is dat virussen binnen serotype 2, 3, 6 en 7 ook ziekte kunnen veroorzaken bij pluimvee, maar zij veroorzaken géén NCD (1).
APMV-1 is bij meer dan tweehonderd verschillende vogelsoorten aangetroffen. De ernst van de ziekte hangt af van zowel de vogel als van de virusstam. We onderscheiden (met toenemende virulentie): avirulent, lentogeen, mesogeen en velogeen (neurotroop of viscerotroop) (1).
Volgens de World Organisation for Animal Health (WOAH) is NCD als volgt gedefinieerd (1):
Een infectie met APMV-1 bij vogels die voldoet aan een van de volgende twee criteria:
- Het virus heeft een intracerebrale pathogeniciteitsindex (ICPI) van ≥0,7 in eendagskuikens (Gallus gallus); of:
- Meerdere basische aminozuren zijn aanwezig op het C-uiteinde van het F2 eiwit en de aanwezigheid van phenylalanine op plek 117 (het N-uiteinde van het F1 eiwit).
Indien het aminozurenpatroon niet kan worden bepaald, dient een ICPI te worden uitgevoerd.
Hoewel het virus (in vergelijking met aviaire influenzavirussen) niet snel muteert en het aantal recombinaties laag is, vindt er wel vaker antigene drift (puntmutaties) plaats. In verloop van tijd heeft dit geleid tot een verscheidenheid aan APMV-1-virussen. Deze worden onderverdeeld in twee klassen. Tot klasse 1 behoren met name avirulente virussen (dus géén veroorzakers van NCD) die endemisch voorkomen bij wilde watervogels (1). Tot klasse 2 behoren de niet-virulente (géén veroorzakers van NCD) en virulente APMV-1-virussen (wél veroorzakers van NCD) die verder onderverdeeld zijn in 21 genotypes (2).
Hoewel alle NCD-virussen binnen de verschillende genotypes tot eenzelfde serotype behoren, bestaan er wel antigenetische verschillen (1,3).
Virusopbouw
Het virus bevat enkelstrengs RNA en is omgeven door een enveloppe met een dubbele lipidemembraan. In dit membraan bevinden zich twee eiwitten die zich presenteren als spikes: haemagglutinine-neuramidase (HN) en het fusie-eiwit (F). Beide glycoproteïnen spelen een rol in de virulentie en besmettelijkheid van het virus. Het HN-eiwit zorgt voor de aanhechting van het virusdeeltje aan de receptor van de gastheercel. Vervolgens stimuleert dit het F-eiwit om het membraan van het virusdeeltje te laten fuseren met het membraan van de gastheercel en als gevolg hiervan vindt translocatie plaats van het nucleocapside (holle structuur waarin het RNA zich bevindt) in het cytoplasma van de gastheercel (4). De door het dier ontwikkelde afweerstoffen zijn voornamelijk gericht tegen deze F- en HN-eiwitten. Onder het lipidemembraan is een matrixeiwit aanwezig (M). Het nucleocapside-eiwit (NP) gaat een interactie aan met fosforeiwitten (P) en een ander groot eiwit (L) wat tezamen het ribonucleoproteïnecomplex (RNP-complex) vormt. Dit dient als sjabloon voor de RNA-synthese (3).

Figuur 1. Moleculaire structuur NCD-virus
Voor het binnendringen van de gastheercel dient het F-eiwit te worden gesplitst (van F0 naar F1 en F2). Virulente stammen hebben op deze splitstingsplek meerdere basische aminozuren aanwezig op het C-uiteinde van het F2-eiwit en een phenylalanine op het N-uiteinde van het F1-eiwit. Deze splitsing kan intracellulair plaatsvinden door furin-like proteases die algemeen voorkomen in de kip. Een infectie met een NCD-virus leidt dan ook tot een systemische replicatie in de kip. Niet-virulente APMV-1-virussen worden gekenmerkt door een enkel basisch aminozuur op het C-uiteinde van het F2-eiwit en leucine op het N-uiteinde van het F1-eiwit. Deze splitsing kan alleen worden gedaan door extracellulaire proteases (trypsin-like) die zich bevinden in de respiratie- en digestietractus. Hierdoor veroorzaken deze virussen slechts een lokale infectie
Gevoelige diersoorten
Meer dan 240 vogelsoorten en 27 van de 50 ordes kunnen de infectie krijgen. Er is wel verschil in pathogeniteit. Kippen (en fazanten) zijn het meest gevoelig, gevolgd door kalkoenen (1,3). Kalkoenen hebben meer virus nodig om geïnfecteerd te raken dan kippen. Eenden en ganzen zijn het minst gevoelig. Wilde vogels en (niet-gevaccineerde) exotisch gehouden vogels zoals aalscholvers (genotype XIX (oude benaming is subgenotype 5a)) (1,2)), duiven en papegaaiachtigen, kunnen een reservoir vormen, omdat zij langdurig virulent virus kunnen uitscheiden, met name via de feces, zonder dat zij klinische verschijnselen hoeven te vertonen (1) (zie hoofdstuk ‘Transmissie & uitscheiding’).
Speciale aandacht verdient het pigeon paramyxovirus type 1 (pPMV-1). Deze duivenvariant van het virus (klasse 2, genotype VI.1.1 (oude benaming is genotype 6b) (2,4)) behoort volgens de definitie van de WOAH tot de velogene NCD-virussen (criteria 2; zie ‘het virus’), hoewel het over het algemeen weinig ziekmakend is voor kippen. Indien een naïef koppel kippen geïnfecteerd raakt met deze duivenvariant, bestaat de mogelijkheid dat na diverse passages in de kip, het virus zich weet aan te passen naar de kip en hierdoor in pathogeniteit voor deze dieren toeneemt. Potentieel kan het virus dus wel ziekmakend zijn in niet-gevaccineerde pluimveekoppels (1). Het pPMV-1 komt bij duiven voor in Europa en is in de afgelopen jaren ook meermalig in Nederlandse (gehouden) duiven aangetoond. Het is daarom van belang dat alle commercieel gehouden pluimveekoppels goed gevaccineerd worden en daarmee beschermd zijn tegen een infectie met dit virus.
Daarnaast bestaat de mogelijkheid dat lentogene virussen, waar wilde (water)vogels een reservoir voor kunnen vormen, bij een infectie bij pluimvee door een aantal mutaties in pathogeniteit zouden kunnen toenemen (1,4).
Transmissie & uitscheiding
De infectie kan zowel respiratoir als per os plaatsvinden. Geïnfecteerde dieren scheiden virus uit via de orofarynx en de mest (1).
Het virus kan het land binnenkomen door import van (sier)vogels die dragers zijn, door wilde vogels die het virus bij zich hebben, door vervoer van materialen die met besmet pluimvee of mest in contact zijn geweest en door mensen of dieren die als vector fungeren (1). Verspreiding binnen en tussen koppels vindt plaats door direct en indirect contact en via de lucht (1). Papegaaiachtigen (ara’s, parkieten en papegaaien) kunnen tot wel een jaar na infectie (intermitterend) virus uitscheiden via de feces en respiratoire uitvloeiingen (4). Ook uilen (meer dan vier maanden) en aalscholvers (een maand) kunnen gedurende langere tijd virus uitscheiden (5). Voor niet-gevaccineerde hoenderachtigen is dit circa 1 tot 2 weken (4).
Verspreiding van besmette haarden via de lucht is aangetoond op een afstand van 64 meter (3), maar niet op een afstand van 165 meter. Bij deze korte afstanden kunnen grote vraagtekens geplaatst worden. De afstand waarop het virus via aerosolen kan worden verspreid, is zeer waarschijnlijk afhankelijk van verschillende factoren, zoals luchtvochtigheid en andere omgevingsfactoren (5). Andere factoren zijn naar alle waarschijnlijkheid ook belangrijk zoals de hoeveelheid uitgescheiden virus (aantal besmette dieren), het aantal gevoelige dieren, de windrichting en het ventilatietype. Overleving van het virus is tevens aangetoond in aardwormen (6) en vliegen, maar onduidelijk is of vliegen voldoende virus dragen om infectieus te zijn (7).
Sommige NCD-stammen hebben een tropisme voor de eileider, wat mogelijk tot verticale transmissie kan leiden. Indien embryo’s geïnfecteerd zouden raken, dan zullen zij het broedproces zeer waarschijnlijk niet overleven, waardoor geen effectieve verticale transmissie zal plaatsvinden (1). Hiermee is een overdracht via kuikens/broederij nog niet uitgesloten omdat de afgestorven eieren die op 18 dagen broeden verwijderd worden veel virus kunnen bevatten en bij het kapot gaan de broederijomgeving kunnen besmetten.
Door virus opgewekte antistoffen kunnen een veldinfectie min of meer subklinisch doen verlopen, terwijl dieren nog wel virus kunnen uitscheiden. Onder experimentele omstandigheden vindt uitscheiding van virus plaats gedurende drie weken. Binnen een koppel vindt circulatie van virus plaats (8).
Volksgezondheid
Infecties met APMV-1-virussen bij mensen is zeldzaam. Het komt met name voor bij mensen die intensief met pluimvee werken (denk aan dierenartsen die NCD-vaccinaties uitvoeren) en mensen die in laboratoria met het virus werken. De verschijnselen bij mensen blijven vaak beperkt tot een zelflimiterende milde conjunctivitis en soms lichte griepachtige verschijnselen (1,9).
NCD-virussen worden gebruikt in de therapeutische behandeling van bepaalde kankersoorten in de humane geneeskunde door hun anti-tumor effecten. Het virus is in staat zich te repliceren in tumorcellen waarbij het de tumorcellen kapot maakt en de ‘normale’ cellen intact houdt (4).
Er zijn geen rapportages bekend over transmissie van het virus van mens naar mens (1,9).
Overleving
In dode dieren en excreta kan het NCD-virus goed overleven, zeker bij koelkasttemperaturen (4). Ook in mest kan het virus lange tijd infectieus blijven. Bij een temperatuur van minstens 37,8 °C was het virus na 7 dagen niet meer aantoonbaar in de mest. Bij een temperatuur van 10 tot 21,1 ⁰C bedroeg dit 112 dagen (10). Inactivatie van het virus gebeurt bij 56 ⁰C in 3 uur. Bij 60 ⁰C vindt dit binnen 30 minuten plaats (3).
Overleving in karkassen kan, afhankelijk van de temperatuur, lang zijn. Bij temperaturen net boven 0 ⁰C (1-2 ⁰C) overleeft het virus op de huid tot 160 dagen en in het beenmerg tot 200 dagen (5).
Desinfectie
Nadat door middel van zeep en ontsmettingsmiddelen organisch materiaal is verwijderd, kan middels zuren (pH≤2), formaldehyden, alkalides (natriumhydroxide), fenolen en oxiderende stoffen zoals natriumhypochloriet het virus worden geïnactiveerd (1,3)
Verschijnselen van NCD
De klinische verschijnselen
APMV-1-virussen, waaronder de virulente NCD-virussen, kunnen zich - afhankelijk van de stam, het type gastheer, de leeftijd, de immuunstatus/vaccinatiestatus, de route van infectie, de hoeveelheid binnengekregen virus en de aanwezigheid van co-infecties - op veel verschillende manieren uiten (1,4,5):
- Lentogene virussen: subklinische infecties of milde respiratoire verschijnselen (zoals benauwdheid en respiratoire bijgeluiden). Indien kliniek wordt gezien, is dit veelal bij jonge naïeve dieren, soms in combinatie met secundaire bacteriële infecties en/of een slecht stalklimaat. Bij naïeve legdieren kunnen deze stammen een legdaling opwekken.
- Mesogene stammen: acute respiratoire klachten, eventueel ook nerveuze aandoeningen (zoals tremoren van de kop, draainekken en paralyse) en bij leggende dieren een productiedaling. De uitval blijft over het algemeen beperkt.
-
Velogene stammen (onder andere afhankelijk van het type stam – neurotropisch versus viscerotropisch):
- plotselinge lethargie;
- acute sterfte;
- eiproductiedaling;
- zwakke eischalen, misvormingen en afwijkende kleur (tot witte eieren bij bruine leghennen);
- verminderde voeropname;
- in elkaar gedoken zitten;
- conjunctivitis met subconjunctivale bloedingen;
- oedeem aan de kop;
- ademnood;
- ademhalingsgeluiden;
- cyanose van de kam;
- dunne, groengekleurde mest;
- excitatie en hypermetrie;
- tremoren van kop en spieren;
- torticollis;
- verlammingsverschijnselen van vleugels en poten.
Ernstige klinische verschijnselen kunnen ook worden waargenomen bij fazanten en patrijzen (1,11), hoewel de respiratoire verschijnselen bij fazanten niet altijd aanwezig zijn (12). Parelhoenders kunnen klinische verschijnselen tonen, maar meestal verloopt zelfs een velogene infectie, net als vaak bij eenden en ganzen (afhankelijk van de stam), subklinisch (5).
De klinische verschijnselen die kunnen worden waargenomen bij duiven met een pPMV-1-infectie wisselen in ernst. Veelal wordt een hoge mortaliteit in combinatie met neurologische verschijnselen en verschijnselen van algemene malaise waargenomen (1). Bepaalde stammen kunnen de nieren aantasten waardoor polyurie kan worden veroorzaakt (5). Overig APMV-1-virussen afkomstig van kippen geven over het algemeen weinig verschijnselen bij duiven, al kunnen tremoren van het lichaam worden waargenomen (1,5).
Incubatietijd
De incubatietijd bedraagt 2 tot 15 dagen (gemiddeld 5 tot 6 dagen), afhankelijk van de virulentie van de stam en de gevoeligheid van de vogelsoort (1). Ook de besmettingsroute en virusdosis spelen een rol. Bij infecties met velogene stammen in pluimvee bedraagt de incubatieperiode gewoonlijk 2 tot 6 dagen (5).
Morbiditeit/ mortaliteit
De morbiditeit is binnen een koppel zeer hoog door de hoge besmettingsgraad van het virus (3). De mortaliteit is afhankelijk van de virulentie van de virusstam, leeftijd, diersoort, vaccinatiestatus, et-cetera: bij mesogene stammen kan de mortaliteit oplopen tot boven de 50% (13) bij velogene stammen tot 100% (1). De gevoeligheid van kalkoenen voor het virus is lager dan de gevoeligheid van kippen (1). Een pPMV-1-infectie bij jonge duiven kan leiden tot een morbiditeit en mortaliteit oplopend tot 100%, bij oudere duiven is de morbiditeit vaak onder de 10% waarbij sterfte kan optreden (14).
Differentiaaldiagnose
De differentiaaldiagnose bij pluimvee is uiteraard afhankelijk van de NCD-stam en de vaccinatiestatus van het koppel. Als indicatie (1,4):
- AI (HP en LP)
- ILT
- IB
- vogelcholera (Pasteurella multocida)
- septische infecties (zoals vlekziekte, listeria)
- Salmonella Enteritidis (jonge dieren)
- acute vergiftiging
- managementfouten (geen water, ernstige ventilatiefouten)
Diagnose van NCD
Klinische symptomen
De belangrijkste klinische symptomen zijn afhankelijk van de virulentie van de NCD-stam. De belangrijkste verschijnselen staan in het hoofdstuk ‘Verschijnselen van NCD’.
Sectie
De sectiebevindingen bij NCD-infecties kunnen sterk wisselen en zijn onder andere afhankelijk van het type dier en de immuunstatus van dit dier.
De belangrijkste macroscopische afwijkingen bij een infectie met een mesogeen/velogeen virus bij pluimvee zijn (1,15,16):
- Necrose en bloedingen van de laryngeale tonsillen en een hemorragische necrotiserende tracheïtis met stuwing;
- Bloedingen, roodheid, oedeem en necrose van het oogslijmvlies en de traanklier (binnenste ooghoek), de caecale tonsillen en de Peyerse platen en ander lymfoïde weefsel (mucosa-geassocieerd lymfoïd weefsel);
- Sepsisbeeld (vergrote, gemarmerde milt) met bloedingen (ten gevolge van trombocytopenie (aantasting beenmergcellen) en endotheelbeschadiging) in de thymus, kliermaag en darmen. Tevens kan microscopisch necrose in diverse organen en weefsels worden waargenomen (zoals in het myocard, beenmerg, darm, lever, thymus, milt, trachea, pancreas en de bursa van Fabricius);
- De ovaria zijn oedemateus en gedegenereerd waarbij een ei-peritonitis kan worden waargenomen.
Het sectiebeeld bij duiven die geïnfecteerd zijn met pPMV-1 kunnen zijn:
- Gezwollen nieren, bleke pancreas, gezwollen en bonte milt met waterige inhoud in de darmen.
Laboratorium
De technieken om NCD-virus aan te tonen zijn:
- RT-PCR op swabs of FTA-cards van trachea of eventueel andere aangedane organen, zoals long, milt, nieren en hersenen;
- IFT-/IHC-kleuring middels histologie van de trachea of eventueel andere aangedane organen, zoals long, milt, nieren en hersenen;
- Viruskweek in eieren van weefsel uit hersenen, trachea, long, milt en eventueel darm;
- Met behulp van serologische testen kunnen NCD-infecties aangetoond worden waarbij gepaard onderzoek nodig is bij gevaccineerde dieren.
- Bepalen van de HAR- en ELISA-titer, afhankelijk van toegepaste vaccinaties. De HAR- en de ELISA-test maken geen onderscheid tussen antistoffen verkregen vanuit een veldinfectie en antistoffen verkregen na vaccinatie met reguliere (levende) vaccins. Afhankelijk van het soort vaccin, kunnen de HAR (gouden standaard) en de diverse soorten ELISA's (klassiek compleet virus antigeen of F-antigeen) de vaccinatierespons aantonen. Bij het gebruik van HVT-F-vaccins zijn de HAR en F-ELISA sneller positief dan bij de klassieke ELISA's.
Binnen Nederland wordt de definitieve diagnose ‘NCD’ altijd gesteld door Wageningen Bioveterinary Research (WBVR), waar met behulp van een ICPI de pathogeniteit van het geïsoleerde virus wordt bepaald. Dit duurt echter minimaal weken tot enkele maanden omdat het virus eerst geïsoleerd moet worden en de ICPI een dierproef is. WBVR zal daarom ook de RT-PCR en whole genome sequencing inzetten.
- Bij een ICPI≥0,7 is er sprake van NCD en onderneemt de overheid de in een draaiboek vastgelegde maatregelen. Ook op basis van een RT-PCR-test (bijvoorbeeld RT-PCR met primersets voor de cleavage site van het F-gen) en sequencen kan onderscheid worden gemaakt tussen virulente en niet-virulente stammen.
Prevalentie van NCD
Nederland
De laatste grote uitbraak in Nederland was in 1992-1993. Er waren toen 61 gevallen met als belangrijkste oorzaak van introductie van velogeen virus: buurtcontact/aerogeen (28%), menscontacten (17%), koppels met een verlaagde immuunstatus (10%), onvolledige vaccinatie (8%) en aankoop (5%). Na de invoer van een verplichte vaccinatie met een geïnactiveerd vaccin bij leg- en reproductie dieren en een levende vaccinatie bij vleeskuikens (spray en aerosol) kwam de uitbraak onder controle.
Commercieel gehouden pluimvee in Nederland is, anno 2025, vrij van veldinfecties met NCD-virus. In Nederland geldt een vaccinatieplicht (zie hoofdstuk ‘Regelgeving’). In duiven zijn in de afgelopen jaren wel enkele gevallen met pPMV-1-virus vastgesteld (zie hoofdstuk ‘Gevoelige diersoorten’). In 2018 is in Nederland NCD-virus aangetoond in hobbymatig gehouden fazanten, behorend tot het VII.2-subgenotype (17).
Europa
NCD is meldingsplichtig en meldingen worden doorgeven aan het WAHIS (World Animal Health Information System) van de WOAH, tot 2003 bekend als de OIE (Office International des Epizooties).
Sinds 2020 hebben in Europa uitbraken bij gedomesticeerde dieren plaatsgevonden in Nederland, Rusland, Roemenië, Bulgarije, Spanje, Denemarken, Noorwegen, Zweden, Moldavië, Frankrijk, Zwitserland, Noord-Macedonië, Malta, Slovenië en Polen (zie Figuur 2 (18). Met name in Polen hebben het afgelopen jaar en tevens in voorgaande jaren erg veel uitbraken van NCD (genotype V.II) plaatsgevonden bij commercieel gehouden pluimvee en backyard poultry. In 2025 is er gestart met een verplicht vaccinatieprogramma van commercieel gehouden pluimvee. Eind 2025 was de situatie nog verre van onder controle. Ook worden maar een deel van de besmettingen gemeld.
In 2018 hebben er in België twintig verschillende uitbraken plaatsgevonden met virus behorend tot het VII.2-subgenotype. Dit betrof 15 hobbyhouders, 2 commerciële legvermeerderaars en 3 pluimveehandelaren (17).
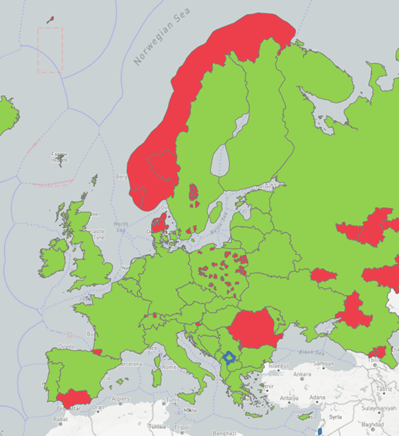
Figuur 2. NCD-uitbraken in Europa in de periode van 2020 tot (deels) 2025. In de figuur staan uitbraken weergeven die gemeld zijn middels WAHIS. Rood geeft de gebieden aan waar uitbraken hebben plaatsgevonden. Groen geeft de afwezigheid van uitbraken weer. Van de blauwe gebieden is geen informatie aanwezig en van de witte gebieden zijn geen uitbraken gemeld of er is geen informatie over beschikbaar in de bekeken periode ) (Bron: WAHIS) Let op: niet alle uitbraken staan vermeld op dit plaatje.
Buiten Europa
Velogeen APMV-1 is endemisch in delen van Azië, Rusland en omringende landen, Centraal- en Zuid-Amerika, het Midden-Oosten, Afrika en Mexico. In veel landen waar het virus endemisch is, worden echter geen meldingen meer doorgegeven aan het WAHIS.
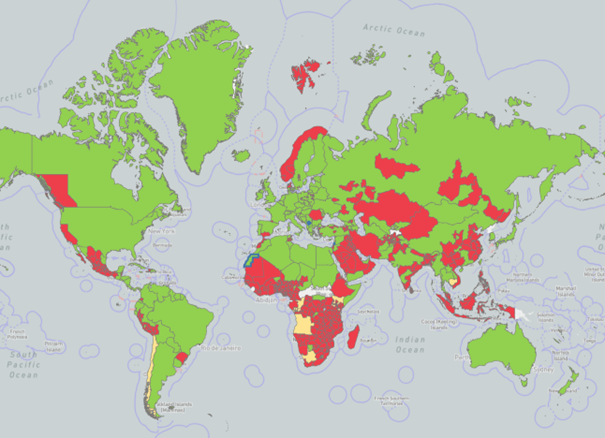
Figuur 3. NCD-uitbraken wereldwijd in periode van 2020 tot (deels) 2025. In de figuur staan uitbraken weergeven die gemeld zijn middels WAHIS. Rood geeft de gebieden aan waar uitbraken hebben plaatsgevonden. Groen geeft de afwezigheid van gemelde uitbraken weer. Van de blauwe gebieden is geen informatie aanwezig en van de witte gebieden zijn geen uitbraken gemeld of er is geen informatie over beschikbaar in de bekeken periode (Bron: WAHIS). Let op: lang niet alle landen melden hun uitbraken bij WAHIS en ontbreken daardoor op deze kaart.
Aanpak besmette bedrijven
Meldingsplichtig
NCD is een meldingsplichtige ziekte volgens artikel 2.12 en 5.3 van de Wet dieren. In de Europese Diergezondheidsverordening (EU) 2016/429 is NCD aangemerkt als categorie A-ziekte, dat wil zeggen dat het een bestrijdingsplichtige dierziekte is. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA. De aanpak van een besmet bedrijf gaat volgens de dan geldende draaiboeken. In Europese regelgeving zijn ook de kaders van bestrijding vastgelegd (gedelegeerde verordening (EU) 2020/687).
Preventie van NCD
Hygiëne
Hygiënemaatregelen:
- Insleep voorkomen door streng toegangsbeleid.
- Contact met andere vogels vermijden.
- Geen dieren aanvoeren van onbekende of verdachte herkomst.
Vaccinatie
- Vaccineren volgens de Regeling houders van dieren, die van toepassing is voor houders van commercieel pluimvee (met uitzondering van eenden).
- In de regelgeving is vastgelegd dat dieren uiterlijk 18 dagen na uitkomen moeten zijn gevaccineerd en dat vanaf 28 dagen een minimale titer aanwezig moet zijn.
- Verplichte controle van vaccinatietiters volgens diezelfde regeling. Basis van de regelgeving is dat dieren boven de 28 dagen en onder de 70 dagen een minimale bescherming hebben, zodat van de 30 te onderzoeken bloedmonsters minimaal 1 monster een HAR-titer heeft van 3 of hoger. Vanaf 70 dagen dient een bescherming aanwezig te zijn, waarbij 25 van 30 te onderzoeken bloedmonsters een HAR-titer hebben van 3 of hoger, tenzij dieren met tussenpozen van ten hoogste zes weken zijn gevaccineerd door de dierenarts met levende entstof middels spray of aërosol. Binnen zes weken na toediening van een geïnactiveerd vaccin (borstprik), dient bij 25 van de 30 te onderzoeken bloedmonsters een HAR-titer van 3 of hoger te worden vastgesteld.
- Er zijn diverse geregistreerde levende vaccins beschikbaar. Sinds 2001 zijn er ook levende vaccins geregistreerd voor toepassing in ovo. Deze vectorvaccins werken met een HVT-vector waarin de genetische informatie van het F-gen is geïncorporeerd.
- Daarnaast zijn er ook meerdere geïnactiveerde vaccins beschikbaar, waarvan de meeste in combinatie met andere pluimveepathogenen.
Wat te doen wanneer er niet aan de titereis wordt voldaan (Regeling houders van dieren)?
- Vleeskuikens: indien twee keer achtereenvolgend de gewenste titer niet wordt behaald, moet er verplicht een plan van aanpak worden opgesteld (in overleg met een dierenarts van de Gezondheidsdienst voor Dieren).
- Vleeskalkoenen: als bij een koppel de titereis niet wordt behaald, dienen de eerstvolgende twee koppels gevaccineerd te worden door de dierenarts.
- (Opfok)vermeerderingsdier of leghen (kip of kalkoen): als de titereis niet wordt behaald, moet het koppel terstond door een dierenarts worden gevaccineerd. Binnen vier weken na vaccinatie, wordt het koppel opnieuw onderzocht middels bloedonderzoek.
Belangrijkste factoren van een onvoldoende titeropbouw of de aanwezigheid van een vaccinatiereactie na vaccinatie zijn:
- Te diepe inhalatie van vaccinvirus als gevolg van:
- Gebruik van een onjuiste of beschadigde nozzle: te hoog percentage druppels met een diameter van minder dan 100 micron.
- Onvoldoende vaccinvirus in het dier:
- Afsterven van virus bij opslag, transport, aanmaak of tijdens vaccineren (spray en drinkwater).
- Het gebruik van vaccinvirus met stabiliserende toevoegingen aan het vaccinatiewater verbetert het resultaat.
- Technische uitvoering van de vaccinatie, onder andere te weinig water of onjuiste dorstperiode.
- Afsterven van virus bij opslag, transport, aanmaak of tijdens vaccineren (spray en drinkwater).
- Vaccineren tijdens slechte omstandigheden:
- Staltemperatuur te hoog, draaiende heteluchtverwarming, draaiende ventilatoren, te lage lichtintensiteit (ogen gesloten).
- Onjuist vaccinatieschema:
- Te hoge maternale immuniteit waardoor de humorale respons verlaagd wordt maar de lokale en T-cel respons nog steeds goed kan zijn;
- Interfentie met andere vaccins, zoals IBV;
- Vaccinatie binnen 14 dagen van een eerdere NCD-vaccinatie. Ook vaccinaties binnen twee weken na IBV-vaccinaties kunnen tot lagere titers leiden.
- Immuunsuppressie:
- Vroege infecties met bijvoorbeeld het Gumborovirus kunnen leiden tot een veel lagere respons van (o.a.) NCD-vaccins.
Werkzaamheid vaccins
Veel onderzoek heeft laten zien dat de levende vaccins (genotype I of II) in staat zijn bescherming op te wekken tegen de moderne veldstammen (veelal genotype VII). Ook HVT-F-vaccins blijken een bredere bescherming op te wekken dan geïnactiveerde vaccins. In landen met veel uitbraken wordt getwijfeld aan deze kruisbescherming en heerst het idee dat GVII-specifieke vaccins nodig zouden zijn.
Regelgeving
Nederlands recht
- De Verordening NCD-bestrijding 1976 van het Landbouwschap regelde de aanwijzing van de verplichte entschema’s en richtlijnen voor de uitvoering daarvan, het verplichte bloedonderzoek en de hokontsmetting.
- Sinds oktober 2006 gold in plaats daarvan de ‘Regeling vaccinatie Newcastle disease’ van PPE/EZ, waarin de entplicht en de controle daarop werd geregeld.
- De serologische NCD-monitoring was gebaseerd op de ‘Verordening vaccinatie Newcastle Disease / PPE) 2006’ en wel het ‘Besluit Bloedonderzoek NCD (PPE) 2006’.
- Sinds 2015 geldt de huidige regelgeving van verplichte vaccinatie en serologische monitoring, sinds 2021 vermeld in de Regeling houders van dieren, §7b.3.3 en Bijlage 12.
- NCD is een besmettelijke dierziekte die door de overheid wordt bestreden. Bij het vermoeden dat er sprake is van NCD moet GD dit melden aan de NVWA (centraal dierziekten-meldnummer: 045 546 31 88).
- Aangifteplicht voor NCD is vastgelegd in artikel 2.12 en 5.3 van de Wet dieren.
De Verordening vaccinatie Newcastle Disease (PPE) 2006 is per 30 juni 2014 vervallen en opgegaan in de Regeling preventie, bestrijding en monitoring van besmettelijke dierziekten, zoönosen en TSE’s. Art. 94. De vaccinatie- en monitoringsverplichting is sinds 21 april 2021 overgezet in de Regeling houders van dieren.
Europees recht
In de Europese Diergezondheidsverordening (EU) 2016/429 is NCD aangemerkt als categorie A-ziekte, dat wil zeggen dat het een bestrijdingsplichtige dierziekte is. In Europese regelgeving zijn ook de kaders van bestrijding vastgelegd (gedelegeerde verordening (EU) 2020/687). De Gedelegeerde verordening (EU) 2020/689 laat lidstaten vrij te kiezen tussen een vrijstatus zonder vaccinatie of met vaccinatie. Nederland heeft voor het laatste gekozen. De EU-regelgeving laat vrij op welke manier het vaccinatieprogramma wordt ingevuld.
Literatuur
- Suarez DL, Miller PJ, Koch G, Mundt E, Rautenschlein S. Newcastle Disease, Other Avian Paramyxoviruses, and Avian Metapneumovirus Infections. In: Diseases of Poultry [Internet]. John Wiley & Sons, Ltd; 2020 [geciteerd 31 mei 2024]. p. 109-66. Beschikbaar op: https://onlinelibrary.wiley.com/doi/abs/10.1002/9781119371199.ch3
- Dimitrov KM, Abolnik C, Afonso CL, Albina E, Bahl J, Berg M, e.a. Updated unified phylogenetic classification system and revised nomenclature for Newcastle disease virus. Infect Genet Evol. 1 oktober 2019;74:103917.
- Dzogbema KFX, Talaki E, Batawui KB, Dao BB. Review on Newcastle disease in poultry. Int J Biol Chem Sci. 23 juni 2021;15(2):773-89.
- Brown VR, Bevins SN. A review of virulent Newcastle disease viruses in the United States and the role of wild birds in viral persistence and spread. Vet Res. 26 oktober 2017;48(1):68.
- Spickler AR. Newcastle Disease. Newctle Dis.
- Kinde H, Utterback W, Takeshita K, McFarland M. Survival of Exotic Newcastle Disease Virus in Commercial Poultry Environment Following Removal of Infected Chickens. Avian Dis. september 2004;48(3):669-74.
- Chakrabarti S, King DJ, Afonso C, Swayne D, Cardona CJ, Kuney DR, e.a. Detection and Isolation of Exotic Newcastle Disease Virus from Field-Collected Flies. J Med Entomol. 2007;44(5).
- Carrasco A de OT, Seki MC, Benevenute JL, Ikeda P, Pinto AA. Experimental infection with Brazilian Newcastle disease virus strain in pigeons and chickens. Braz J Microbiol. maart 2016;47:231-42.
- Abdisa T, Tagesu T. Review on Newcastle Disease of Poultry and its Public Health Importance. J Vet Sci Technol. 1 januari 2017;08.
- Mo J, Stephens CB, Spackman E. The Thermal Stability of Newcastle Disease Virus in Poultry Litter. Avian Dis. 1 juni 2022;66(2):131-4.
- Irvine RM, Aldous EW, Manvell RJ, Cox WJ, Ceeraz V, Fuller CM, e.a. Outbreak of New castle disease due to pigeon paramyxovirus type 1 in grey partridges (Perdix perdix) in Scotland in October 2006. Vet Rec. 2009;165(18):531-5.
- Aldous EW, Alexander DJ. Newcastle disease in pheasants (Phasianus colchicus): A review. Vet J Lond Engl 1997. februari 2008;175(2):181-5.
- Alexander DJ. Newcastle disease in the European Union 2000 to 2009. Avian Pathol. 1 december 2011;40(6):547-58.
- Dodovski A, Cvetkovikj I, Krstevski K, Naletoski I, Savić V. Characterization and Epidemiology of Pigeon Paramyxovirus Type-1 Viruses (PPMV-1) Isolated in Macedonia. Avian Dis. juni 2017;61(2):146-52.
- Etriwati, Ratih D, Handharyani E, Setiyaningsih S. Pathology and immunohistochemistry study of Newcastle disease field case in chicken in Indonesia. Vet World. september 2017;10(9):1066-71.
- Mousa MR, Mohammed FF, El-deeb AH, Khalefa HS, Ahmed KA. Molecular and pathological characterisation of genotype VII Newcastle disease virus on Egyptian chicken farms during 2016–2018. Acta Vet Hung. 30 juni 2020;68(2):221-30.
- Steensels M, Van Borm S, Mertens I, Houdart P, Rauw F, Roupie V, e.a. Molecular and virological characterization of the first poultry outbreaks of Genotype VII.2 velogenic avian orthoavulavirus type 1 (NDV) in North-West Europe, BeNeLux, 2018. Transbound Emerg Dis. 2021;68(4):2147-60.
- WAHIS [Internet]. [geciteerd 16 december 2025]. Beschikbaar op: https://wahis.woah.org/#/dashboards/country-or-disease-dashboard