- Home
- Diergezondheid
- Dierziekten
- Afrikaanse-varkenspest
Afrikaanse varkenspest
Afrikaanse varkenspest (AVP) is een meldingsplichtige ziekte ingevolge de Europese verordening; ‘de Animal Health Regulation’ EU/2016/429. Deze virusziekte wordt veroorzaakt door het Afrikaanse Varkenspest Virus (AVPV). In het Engels wordt de ziekte African Swine Fever (ASF) genoemd, in het Duits Afrikanische Schweinepest en in het Frans Pesti Porcine Africaine. De ziekte kenmerkt zich door sterfte en bloedingen, maar andere verschijnselen en een milder ziekteverloop zijn zeer wel mogelijk.
Meldingsplicht
Elke klinische verdenking moet via het Landelijk meldpunt Dierziekten worden gemeld; telefoonnummer 045 - 546 31 88.
De NVWA heeft vanaf de melding de regie. Bij afhandeling van verdenkingen en bij de bestrijding zijn de NVWA-draaiboeken het uitgangspunt en zijn de dan geldende regelgeving en instructies van de NVWA leidend.
Uitbraken van AVP resulteren meestal in grote schade, zowel door ziekte en sterfte van dieren, als economisch door transport- en handelsbeperkingen.
De rol van GD
GD assisteert de overheid in geval van een verdenking op of bestrijding van een uitbraak van AVP. Verder is de afdeling pathologie van GD extra alert op verschijnselen van AVP bij varkens die voor sectie naar GD komen en zal bij een verdenking de NVWA op de hoogte brengen en extra orgaanmateriaal naar WBVR insturen. Tonsillen van routinematig ter sectie aangeboden varkens worden standaard ook onderzocht op AVP.
GD verzorgt voorlichting over de preventie van AVP via publicaties in de GD-bladen, op de website en door middel van lezingen voor varkenshouders, dierenartsen, voorlichters en jagers.
GD participeert in de gezamenlijke preventie-strategie van overheid en bedrijfsleven in de ‘Roadmap Preventie Introductie AVP’. In 2020 is het eindrapport over de Roadmap opgeleverd en beschikbaar.
In 2023 is GD betrokken bij afstemming met dierenartsenpraktijken om dierenartsen nader te informeren over preventie en eventuele maatregelen bij een uitbraak. Dit gebeurt in samenwerking met LNV, NVWA en WBVR. Tevens heeft de overheid een factsheet diagnostiek KVP en AVP gepubliceerd, welke is verzonden aan dierenartsen als bijlage bij de ‘Veterinair’. Deze flyer is ook online te raadplegen.
Meer informatie vind je in ons dossier Afrikaanse varkenspest
Veterinair kennisdossier Afrikaanse varkenspest
- Verschijnselen
- Diagnose
- Prevalentie
- Regelgeving
- Aanpak besmette bedrijven
- Preventie
- Websites en literatuur
De kiem
Het AVP-virus is een lineair dubbelstrengs DNA-virus en de enige vertegenwoordiger van het genus Asfivirus in de familie Asfarviridae. Alleen varkens zijn gevoelig voor AVP-virus (AVPV). Het is het enige bekende DNA arbovirus.
De standaard nmenclatuur (naamgeving) is gebaseerd op de stad of het land van isolatie en de twee laatste cijfers van het jaar van isolatie (bijvoorbeeld Netherlands 86 of Malta 78). In andere publicaties wordt de naamgeving uitgebreid met de species waarin het gevonden is (bijvoorbeeld ASFv/Kirkutsk/dom/2017 (voor een in 2017 gevonden stam in Kirkutsk in gedomesticeerde varkens) of ASFv/Georgia/wb/2007 (voor een stam uit wilde varkens die in 2007 gevonden is in Georgië) (Malladi, et al. 2022, Kolbasov, et al. 2018).
Het AVP-virus heeft een buitenste envelop (met eiwitten p12 en p24), een viraal kapsel (‘viral capsid’, met eiwit p72), een binnenste envelop (met p12, p54 en p17 eiwitten), een schaal rondom de kern (‘core shell’, polyprotein220 en polyprotein62) en de kern zelf (p10). Al deze lagen maken het virus buitengewoon resistent tegen invloeden van buitenaf (Salas en Andres, 2013).
Het virus is ongeveer 170-190 kb groot met een groot conservatief deel (C region, van 125kb) en twee zogenaamd meer variabele delen (Cackett, et al. 2020, Malogolovkin, et al. 2015). Gebaseerd op sequentie-analyse van het B646L-gen, dat codeert voor het major capside eiwit p72, kunnen 24 genotypen worden onderscheiden (Hailong Qu, et al. 2022). Hiervan zijn er 21 aangetoond in gedomesticeerde of wilde varkens uit Oost- en Zuid-Afrika. Genotype 1 wordt sinds 1957 hoofdzakelijk aangetroffen in West- en Centraal-Afrika, Europa, het Caribische gebied en Brazilië. De huidige wereldwijde epidemie, die in 2007 startte in de Kaukasus, wordt veroorzaakt door genotype 2 (Rowlands, et al. 2008).
Onderzoek naar andere genoomregio’s (E183L en CP204L, coderend voor het p54 en p30 eiwit, en de centrale variabele regio binnen ORF B602L) heeft geleid tot het vinden van subgroepen binnen meerdere van de genotypen (Rowlands, et al. 2008).
Gevoelige diersoorten
Alleen varkens zijn gevoelig voor het virus. In de familie van ‘Suidae’ zijn alle genera gevoelig voor AVPV, zowel het gedomesticeerde varken (Sus scrofa domesticus) als de wilde zwijnen (Sus scrofa), en de Wrattenzwijnen (Phacochoerus spp.). Infecties van het gedomesticeerde en het wilde zwijn verlopen relatief vaak ernstig en lethaal.
Volksgezondheid
De mens is niet gevoelig voor het virus.
Overleving
Het virus is zeer resistent in de omgeving, met name bij koude temperaturen. Het wordt geïnactiveerd bij hogere temperaturen (70 min bij 56°C, 20 min bij 60°C of >70°C) (.OIE Technical Disease Card AFRICAN SWINE FEVER, 2019). Het virus is stabiel tussen pH 4,0 en 11,5 maar wordt geïnactiveerd bij pH<3,5 of pH>11,5 mits het medium vrij is van organisch materiaal. Vooral serum verhoogt de resistentie van het virus; het virus blijft bij een pH van 13 eenvoudig een week infectieus mèt serum terwijl het maximaal een dag infectieus blijft zonder serum. De infectieusiteit van AVPV in producten en varkensproducten is de afgelopen jaren redelijk uitvoerig onderzocht en beschikbaar via diverse bronnen (EFSA, 2014). Een beknopt overzicht is beschikbaar in Tabel 1.
In de omgeving (zoals zand of strooisel) is aangetoond dat het virus tot zeker bijna twee jaar infectieus aanwezig kan blijven wanneer geen aanvullende maatregelen worden genomen.
Tabel 1. Duur van AVPV infectieusiteit in verschillende materialen en matrices.
|
Materiaal / omgeving |
Duur (in dagen) |
|
Gekookt vlees (> 30 min bij 70°C) |
0 |
|
Bloedzuigende vliegen |
2 |
|
Faeces (bij 37°C) |
3,7 |
|
Faeces (bij 4°C) |
8,5 |
|
Oral fluids |
10 |
|
Faeces (bij kamer temperatuur) |
>11 |
|
Gecontamineerd varkenshok |
30 |
|
Gerookt vlees (ontbeend) |
30 |
|
Vlees (met en zonder beenderen) of gehakt |
105 |
|
Mest (inclusief urine) (gekoeld) |
112 |
|
Gekoeld vlees |
150 |
|
Faeces (gekoeld) |
159 |
|
Gezouten vlees |
182 |
|
Huid en vet (gedroogd of niet) |
300 |
|
Gedroogd vlees (zoals Iberico of Parmaham) |
300 |
|
Bloed (bewaard bij 4°C) |
>500 |
|
Bevroren vlees |
1000 |
|
Teken (Ornithodorus spp.) |
>1500 |
bron: geselecteerd en gebaseerd op EFSA, Scientific Opinion on African swine fever, EFSA Journal, 2014; 12(4): 3628. De duur geeft een bekende of geschat maximum duur van infectieusiteit aan. Temperatuur en vochtigheidsgehalte kunnen de waarden sterk beïnvloeden.
Desinfectie
Het virus is gevoelig voor vetoplossende reinigings- of desinfectiemiddelen, alsmede oxiderende stoffen (zoals fenol of hypochloriet). Deze stoffen werken in op het kapsel van het virus.
Geschikte detergentia:
- Anionische producten (bijvoorbeeld zeep) zijn negatief geladen alkalische zouten van vetzuren. Deze producten zijn sterke detergentia en zwakke desinfectantia.
- Niet-ionische detergentia zijn ongeladen producten met een goede emulsievorming en een goed doordringend vermogen, beperkte schuimvormende eigenschapen en een geringe desinfecterende activiteit.
- Kationische producten zijn positief geladen oplossingen met enige werkzaamheid tegen virussen met een kapsel envelop. Quaternaire ammoniumverbindingen behoren tot deze groep.
Welke desinfectiemiddelen kan ik gebruiken in Nederland?
Op de website van het Ctgb (College voor de toelating van gewasbeschermingsmiddelen en biociden) is te vinden welke middelen geregistreerd zijn in dierverblijven en/of transportmiddelen als desinfectiemiddel tegen AVPV.
Op de website van de NVWA is ook een lijst te vinden met toegelaten producten voor Reiniging en Ontsmetting van transportmiddelen; zie de lijst van de NVWA 'Lijst toegelaten ontsmettingsmiddelen R&O AVP'.
In het algemeen geldt; lees de bijsluiter van het desinfectiemiddel voor effectief èn veilig gebruik en controleer de website van het Ctgb voor wijzigingen.
Verschijnselen van Afrikaanse varkenspest
Klinisch beeld
Incubatieperiode
Het klinisch beeld hangt sterk samen met de grootte van het koppel, hoe lang het virus al aanwezig is in het koppel en wat de blootstellingsroute is geweest. Een ‘punt’-introductie bij dieren in een hok van een bedrijf leidt minder snel tot uitgebreide verspreiding in vergelijking met bijvoorbeeld een introductie via besmette naalden of gecontamineerd voer. Hoewel AVPV vaak wordt geassocieerd met acute massale sterfte moet men vooral bedacht zijn op AVPV (of KVP) bij sluimerende klachten en langzaam toenemende sterfte in een koppel. Bij twijfel altijd melden (Factsheet Diagnostiek AVP en KVP | Publicatie | NVWA, Stand: 22-12-2023).
Het is belangrijk om onderscheid te maken tussen de incubatieperiode in individuele dieren en de tijd tussen introductie en detectie in een koppel dieren. De tijd tussen introductie en detectie is vooral van belang voor de kans op transmissie tussen bedrijven en hangt af van de incubatieperiode voor individuele dieren èn de mate van verspreiding binnen het bedrijf èn de meldingsbereidheid.
Voor individuele dieren is de incubatieperiode bij experimentele infectie kort en relatief constant (gemiddeld 4 dagen (spreiding tussen 2 en 5)). Bij natuurlijke besmetting is de incubatieperiode meer variabel en ligt die tussen de 4 tot 19 dagen. De lengte van deze periode hangt af van de infectiedosis en de infectieroute. Orale opname van infectieus materiaal of parenterale besmetting zijn efficiënte besmettingsroutes (Gallardo, et al. 2015).
Verschijningsvormen
In handboeken worden vier verschijningsvormen van AVP onderscheiden, peracuut, acuut, subacuut en chronisch met bijbehorende klinische verschijnselen en macroscopische bevindingen bij sectie (Tabel 2). Verschijnselen zijn niet exclusief voor een verschijningsvorm.
Tabel 2. Verschijningsvormen en mogelijke klinische verschijnselen van AVPV.
|
Verschijningsvorm |
Per-acuut |
Acuut |
Sub-acuut |
Chronisch |
|
Sterfte |
Binnen enkele dagen tot 90-100% |
Binnen 7-10 dagen, sterfte 90-100% |
Deel herstelt na 3-4 weken. 70% sterfte |
30% sterfte |
|
Koorts |
Hoog tot 42°C |
Hoog |
Matig |
Intermitterend of geen |
|
Gedrag en bewustzijnsniveau |
Verminderde activiteit en zwakte (lethargie)
Kan worden gemist door zeer snel verloop |
Verminderde activiteit en zwakte (lethargie) |
Verminderde activiteit en zwakte (lethargie) |
Matig verminderde activiteit of zwakte (lethargie) |
|
Eetlust (anorexie) |
Sterk veminderd, maar soms pas na eerste sterfte van dieren in koppel |
Verminderd |
Matig verminderd |
Matig tot niet verminderd |
|
Conditie |
Goed |
Goed |
Matig |
Vermageren / slijten |
|
Huid |
Erytheem, maar soms afwezig |
Erytheem en/of gedemarkeerde hyperaemische zone Cyanose Bloedingen |
Erytheem Cyanose Bloedingen |
Necrotische gebieden |
|
Digestie |
- |
Diarree mogelijk, eventueel met bloedbijmenging of melena Braken (incidenteel) |
Diarree mogelijk Braken (incidenteel) |
Diarree mogelijk Braken (incidenteel) |
|
Respiratie |
- |
Dyspneu Neusuitvloeiing |
|
Hoesten t.g.v. secundaire infecties |
|
Reproductie |
- |
- |
Abortus (hoeft niet) |
Abortus (hoeft niet) |
|
Secundaire infecties die leiden tot |
- |
- |
Diarree |
Diarree, hoesten, gewrichtsontsteking |
|
Thrombocytopenie bij bloedonderzoek |
- |
- / + |
+ |
- |
|
Leukopenie bij bloedonderzoek |
- |
- |
+/- |
+/- |
Tabel 3. Bevindingen bij pathologisch onderzoek
|
Verschijningsvorm |
Per-acuut |
Acuut |
Sub-acuut |
Chronisch |
|
Algemeen |
Bloedingen in interne organen en spieren |
Bloedingen in interne organen en spieren |
|
|
|
Huid |
|
|
Focale necrose |
Focale necrose |
|
Hart |
- |
Bloedingen in epi- en endocard |
Bloedingen in epi- en endocard en hydropericard |
Fibrineuze pericarditis |
|
Longen |
- |
Ernstig alveolair oedeem Soms ook bloedingen |
|
Pleuritis en pneumonie |
|
Milt |
- |
Hyperaemische splenomegalie |
Gedeeltelijke hyperaemische splenomegalie of focale infarcten |
Vergroot met normale kleur |
|
Darmen |
- |
Petechiën en ecchymoses (bloedingen) in darmen |
Petechiën en ecchymoses (bloedingen) in darmen |
|
|
Galblaas |
- |
Petechiën |
Galblaaswand-oedeem |
- |
|
Nier |
- |
Petechiën, met name in de cortex |
Petechiën, in de cortex, medulla en pelvis en peri-renaal (of retroperitoneaal) oedeem |
- |
|
Urineblaas |
- |
Petechiën |
Petechiën |
|
|
Lympheknopen |
- |
Gastrohepatisch en gemarmerd |
Bloedstolsel aspect |
Gezwollen |
|
Hersenen |
- |
Oedeem in meningen of hersenen |
Oedeem in meningen of hersenen |
|
|
Tonsillen |
- |
- |
- |
Focale necrose |
Bron: gebaseerd op informatie uit FAO ASF Detection and diagnosis, a manual for veterinarians based, 2017 en Center of Food Security and Public Health, University of Iowa 2022.
Morbiditeit en mortaliteit
AVPV wordt vaak onterecht geassocieerd met hoge en massale sterfte. Hoewel geïnfecteerde varkens op den duur meestal allemaal sterven is de massaliteit sterk afhankelijk van de mate van verspreiding binnen het koppel. De besmettelijkheid (‘infectieusiteit’ of ‘contagiousness’) van AVPV is, in tegenstelling tot wat vaak wordt gesteld, niet bijzonder hoog. Binnen het hok infecteert een geïnfecteerd dier gemiddeld 1 ander dier per dag (βbinnen= 1 (Nielsen, et al. 2017)) en omdat dieren binnen ongeveer een week overlijden is R0 ongeveer 5. Tussen hokken verloopt de transmissie veel langzamer; een geïnfecteerd dier infecteert gemiddeld eens per 2 dagen een dier in een ander hok (βtussen=0.46 (Nielsen, et al. 2017)). Wanneer de verspreiding binnen en tussen hokken wordt vergeleken middels R0, blijkt hetzelfde; bij een uitbraak in een naïef bedrijf is de transmissie binnen het hok hoog (R0 = 5 (95%CI: 2-9), maar de transmissie tussen hokken lager (R0 =2.7 (95%CI 0.7-5.2) (Depner, et al. 2017).
Derhalve kan, door de tragere verspreiding tussen hokken èn vroege onderkenning en detectie, de initiële morbiditeit beperkt zijn. Waardoor, wanneer uitval percentage als richtlijn wordt genomen om te melden, vooral in grote bedrijven het risico bestaat dat een uitbraak pas relatief laat leidt tot alarmerende verschijnselen en meldingswaardige sterfte (Lamberga, et al. 2020).
De morbiditeit is afhankelijk van de virulentie van de virusstam, de infectieroute en de verspreiding binnen het koppel, en de uitingsvorm op moment van detectie. Immers bij mildere uitingsvormen kan mogelijk pas later aan AVP gedacht worden waardoor het virus reeds verder verspreid is in het koppel. De letaliteit bij het momenteel actuele virus is 90 – 100 procent. In het verleden is bij laag virulente stammen lagere letaliteit gerapporteerd, tot 30 procent (Sánchez-Vizcaíno, et al. 2019). Dieren die de acute infectie overleven blijven echter wel virus uitscheiden en zijn in staat andere dieren te infecteren (Eblé, et al. 2019)
Bij wilde zwijnen kan de letaliteit ook lager zijn, blijkend uit het feit dat in Europa bij verschillende uitbraken enkele wilde zwijnen zijn aangetroffen met afweerstoffen tegen het virus. Deze varkens vormen een verspreidingsrisico aangezien deze dieren, ondanks de aanwezigheid van antistoffen, het virus lang bij zich kunnen dragen.
Uitscheiding van de kiem
Het AVP-virus kan in mest, maar ook in bloed, speeksel, neusuitvloeiing, slijm, weefsel (ook vlees), sperma en urine voorkomen. Gehouden varkens worden meestal geïnfecteerd door oronasale opname van het virus doordat voer, materialen of transportmiddelen gecontamineerd zijn met se- of excreta van geïnfecteerde dieren. Een andere relevante besmettingsroute is het voeren van gecontamineerd en onvoldoende verhit keukenafval (swill) aan varkens. In varkensvlees, vleesproducten en slachtafval (swill) kan het virus na enkele maanden nog infectieus zijn en in bevroren vlees zelfs na enkele jaren nog. Deze route is bekend als oorzaak van uitbraken in Nederland in 1986, maar ook de huidige epidemie lijkt begonnen te zijn als gevolg van voeren van swill aan varkens in de Kaukasus in 2007. Het voeren van keukenafval (swill) aan varkens is verboden in Nederland.
Vectoren als huisdieren, ongedierte of insecten kunnen het virus mechanisch verspreiden. Verspreiding door vogels is niet waarschijnlijk. Het is niet bekend of het AVP-virus ook via de lucht verspreid kan worden. De halfwaardetijd van het virus in lucht is kort, namelijk ongeveer 15 minuten (de Carvalho Ferreira, et al. 2013). Overdracht via lucht binnen een stal lijkt daardoor niet onmogelijk, maar tussen bedrijven is het zeer onwaarschijnlijk. In stalvliegen en horzels nabij uitbraken is DNA van AVPv aangetoond en het is bekend dat dit enige tijd aanwezig blijft. Voor stalvliegen is ook aangetoond dat die kunnen bijdragen aan de verspreiding van AVP naar varkens, voor horzels wordt dit nog nader onderzocht maar dit lijkt aannemelijk (EFSA, 2024). Het is echter onduidelijk hoe vaak deze vliegen een rol spelen bij de verspreiding.
In Afrika verspreiden zachte teken, van de genera Ornithodoros spp., AVPV genotype 1, omdat het virus zich daarin ook weet te vermeerderen. De teken verspreiden virus onder andere onder de bos en wrattenzwijnen. In harde Europese teken kan AVP zich niet vermeerderen (de Carvalho Ferreira, et al. 2014). Zachte teken (Ornithodoros spp.) komen ook voor op het Iberisch schiereiland èn rondom de Zwarte Zee (ECDC, 2020), maar spelen voor zover nu bekend geen rol in de huidige epidemie van AVPV (EFSA, 2024).
In Tabel 4 wordt het relatieve belang van verschillende infectieroutes aangegeven. Hygiënemaatregelen om het virus buiten een bedrijf te houden zijn dan ook zeer belangrijk.
Deze hygiënemaatregelen worden besproken bij preventie.
Tabel 4. Verspreidingsroutes van het virus
|
Infectieroute: |
Belang: |
|
Direct contact met varkens |
++++ |
|
Indirect door vlees |
++++ |
|
Teken (door Ornithodoros spp.) |
+++ (vooral in Afrika) |
|
Indirect door swill |
+++ |
|
Indirect door bezoekers |
++ |
|
Indirect door vervoer / materiaal |
++ |
|
Indirect door mest |
++ |
|
Indirect door sperma |
+ |
|
Ongedierte |
+ |
|
Lucht |
- |
Noot: Indirecte transmissie vindt meestal plaats door contaminatie van materiaal met slijm, urine, feces, sperma, weefselresten of bloed van geïnfecteerde dieren.
Differentieel diagnostiek
Doordat de verschijnselen van AVP niet zeer specifiek zijn, komen vele aandoeningen in aanmerking in de differentiaaldiagnose. In onderstaande tabel staan enkele ziektes die differentiaal diagnostisch in aanmerking kunnen komen bij enkele klinische verschijnselen van AVP. Voor andere, meer algemene, verschijnselen dient AVPV derhalve altijd als ‘red flag’ te worden afgewogen en onwaarschijnlijk worden geacht voordat men doorgaat met diagnostiek.
Tabel 5. Enkele differentieel diagnostische aandoeningen voor de drie meest opvallende verschijnselen van AVP (acute sterfte, hoge koorts en huidafwijkingen) en in geval verschijnselen van meerdere aangedane orgaansystemen worden geobserveerd.
|
Acute sterfte |
Hoge koorts |
Huidafwijkingen(verkleuring/ bloedingen) |
Verschijnselenaanmeerdere orgaansystemen (bijv. respiratie & digestie of resp & zenuw-verschijnselen) |
|
Klassieke varkenspest |
Klassieke varkenspest |
Klassieke varkenspest |
Klassieke varkenspest |
|
Ziekte van Aujeszky |
Ziekte van Aujeszky |
|
Ziekte van Aujeszsky |
|
Virale encephalitis |
Virale encephalitis |
|
|
|
|
Septicaemie |
Septicaemie |
Septicaemie |
|
Streptococcen infectie |
Streptococcen infectie |
|
|
|
PRRSv (virulente stam) |
|
PRRSv |
|
|
|
Vlekziekte / Erysipelas |
Vlekziekte / Erysipelas |
|
|
Acute Pasteurellose en/of Actinobacillose
|
|
PMWS/PDNS |
Corona virussen |
|
|
Salmonellose (bijv. t.g.v.S. choleraesuis) |
Salmonellose (bijv. t.g.v.S. choleraesuis) |
|
|
|
|
Trombocytopenia purpurea |
|
|
Intoxicaties / vergiftigingen met bijv zware metalen |
|
Intoxicaties / vergiftigingen (cumarine, bepaalde mycotoxinen zoals aflatoxine, of pesticiden) (vergiftigingen gaan vaak gepaard zonder koorts) |
|
Diagnostiek
Uitvoering van diagnostiek voor AVP naar aanleiding van een verdenking wordt uitgevoerd bij WBVR in Lelystad.
Pathologie
Macroscopische bevindingen zijn in tabelvorm beschreven in het hoofdstuk ‘klinische bevindingen’ (Tabel 3). De macroscopische bevindingen kunnen uiteenlopen van vrijwel géén bevinding tot ernstige verdenking van AVP op basis van aanwezige (punt-)bloedingen, miltinfarcten, retroperitoneaal oedeem etc. Er kan ook sprake zijn van weinig specifieke bevindingen in geval van een chronisch verloop ten gevolge van secundaire infecties.
Het virus infecteert en vermeerdert zich met name in lymfoïd weefsel, met name de macrofagen, monocyten en ook in lymfocyten, neutrofiele granulocyten. Een eerste viraemie is vanaf acht uur na infectie te vinden en een tweede golf vanaf 15 tot 24u na infectie. Infectie leidt tot massale sterfte van macrofagen wat vervolgens resulteert in vrijkomen van cytokines en complementactivering. Tevens ontstaat een thrombocytopenie, maar er is discussie of dit komt door afbraak van megakaryocyten of een verstoorde thrombocyten aanmaak. Lymfocyten verdwijnen ook door apoptose evenals andere lymfoïde cellen, ten gevolge van de vrijgekomen cytokines uit de macrofagen. Tot slot is er sprake van een gestoorde haematopoëse en verstoorde immuunfuncties. Met name het laatste kan, wanneer de acute fase wordt overleefd, bijdragen aan het ontstaan van secundaire infecties.
De gevolgen van de sterfte van lymfoïde bloedcellen is ook microscopisch zichtbaar. Er ontstaat uitgebreide necrose van lymfocyten en monocyten/macrofagen. Degeneratie van vaatwand-endotheel en thrombose. In de witte pulpa van de milt is sprake van lymfoïd depletie met uitgebreide necrose van macrofagen en lymfocyten. In lymfeknopen zijn bloedingen zichtbaar. In de long ziet de patholoog een verdikking van de wand van de longblaasjes en thrombose in de bloedvaten. In de lever is necrose van de periportale hepatocyten met lymfocyteninfiltratie te zien. In de nieren is tubulus degeneratie met thrombose en focale glomerulonefritis te vinden. In het centraal zenuwstelsel is perivasculaire verdichting te zien met necrotisch debris (Salguero, 2020).
Aantonen van de kiem
Isolatie van AVPV is voorbehouden aan het nationale referentielaboratorium; in Nederland is dit WBVR. Hoewel virusisolatie en immunofluorescentie testen bruikbare diagnostische testen kunnen zijn voor het aantonen van AVPV, bestaat de diagnostiek tegenwoordig met name uit het aantonen van genetisch materiaal van AVPV middels PCR. Voor uitsluitingsdiagnostiek wordt de PCR test uitgevoerd bij WBVR. Positieve AVP uitslagen in PCR worden bevestigd met een herhaalde uitvoering van de PCR test. Virusisolatie wordt toegepast na een eerste uitbraak om het virus ook in handen te krijgen.
De PCR test kan binnen enkele dagen tot ten minste zes maanden na infectie genetisch materiaal van het AVP-virus aantonen in bloed of weefsel.
Tabel 6: Overwegingen bij keuze voor een diagnostische methode en eigenschappen van laboratoriumtesten voor AVP
| Doel diagnostiek | Test | Materiaal | Aantonen van | Positief (tijd na infectie) | Tijd tot uitslag |
| Snelle diagnostiek, zieke dieren | Kliniek | varken | symptomen | >2 dagen | |
| IFT | tonsil, milt, nier, ileum | antigeen | 1-5 tot 18 dagen | ~6 uur | |
| virusisolatie | organen, EDTA-bloed | antigeen | 1-5 tot 7-14 dagen | ~5 dagen | |
| PCR | organen, bloed | viraal DNA | 2 dagen tot heel lang | <1 dag | |
| Screening, niet zieke dieren | ELISA | serumbloed | antilichamen | >14 dagen | ~1 dag |
Serologie
Gezien de hoge letaliteit van AVP is de kans om antistof-positieve varkens te vinden zeer gering. Wanneer varkens de acute fase overleven zijn IgG afweerstoffen aantoonbaar tussen zes dagen en tien maanden na de infectie. Bij uitbraken onder wilde varkens in België en Tsjechië zijn enkele dieren gevonden met antistoffen.
Passieve (maternale) immuniteit kan tot zeven weken duren.
Afhankelijk van het beoogde doel komen uiteenlopende diagnostische methoden in aanmerking.
Prevalentie
Nederland
Nederland is vrij van AVP.
Er vindt surveillance plaats voor AVP op basis van periodieke klinische inspecties van de bedrijfsdierenarts. Tevens worden signalen uit telefoontjes naar GD-Veekijker en de sectiezaal beoordeeld op mogelijke aanwijzingen voor AVP.
De dierenarts heeft daarnaast de mogelijkheid om, kosteloos, EDTA-bloedjes in te sturen naar WBVR, Lelystad, voor uitsluitingsdiagnostiek/‘early warning’-onderzoek. Er is hiervoor geen wettelijke verplichting meer. De meldplicht bij verdenkingen door de houder èn dierenarts blijft onverminderd van kracht. In 2023 is door LNV een factsheet gepubliceerd en verstuurd met handvatten wanneer monsters ingestuurd kunnen worden en/of een melding van een verdenking gedaan moet worden.
Noot: Voorheen was via de Regeling preventie, bestrijding en monitoring van besmettelijke dierziekten en zoönosen en TSE’s (art. 82) het expliciet verboden om varkens te houden als niet was voldaan aan het insturen van monsters of dieren voor onderzoek naar varkenspest. Deze regeling is als zodanig niet meer geldig met het vervallen van de Regeling TSEs.
Tonsillen van varkens aangeboden ter sectie, bij GD alsmede bij aangesloten veterinaire praktijken en het VPDC in Utrecht, worden tegenwoordig allemaal standaard getest op AVP middels PCR.
Het melden van een verdenking van AVP bij de NVWA is verplicht voor veehouder en dierenarts.
Voor AVP in gehouden varkens loopt geen monitoringsprogramma, omdat de huidige AVP-stammen in de meeste gevallen zorgen voor uitval van de dieren (sterftepercentage tot 90-100%). Vaak overlijden de besmette dieren al voordat er antistoffen gevormd zijn.
In wilde zwijnen is er wel een monitoringsprogramma gericht op antistoffen tegen AVP, KVP en ZvA. Om nieuwe besmettingen van meldingsplichtige dierziekten in wilde zwijnen op te sporen is er een protocol “dood gevonden wild zwijn” (Dood wild zwijn gevonden? - WUR; Stand: 22-12-2023). Dit protocol is bij de grofwildcoördinatoren van de provincies bekend.
Andere landen
EuropaNa eradicatie van AVP op het Iberisch schiereiland in de vorige eeuw was het virus nog jarenlang endemisch aanwezig op Sardinië (genotype 1). Sinds 2007 is het virus endemisch in de Kaukasus (genotype 2).
Sinds 2014 zijn uitbraken gemeld bij zowel gehouden varkens en of bij wilde zwijnen in het oosten van Europa, namelijk de Baltische staten, Polen, Wit-Rusland, Roemenië, Oekraïne, Hongarije, Bulgarije, Noord-Macedonië, Albanië, Moldavië, Servië, Kroatië, Slowakije. Vanaf 2020 worden ook uitbraken gerapporteerd in Griekenland en in de Balkan landen, en Duitsland. Alle gevallen zijn van het genotype 2.
In Tsjechië (2017) en België (2018) zijn relatief grote uitbraken van AVP bij wilde zwijnen geweest, maar is men ook in staat gebleken om het virus succesvol tot staan te brengen. In Zweden is in 2023 een relatief beperkte uitbraak van AVP geweest bij wilde varkens rondom een vuilstort. Ook deze uitbraak is succesvol bestreden. België en Zweden zijn weer officieel vrij van AVP.
In 2022 hebben er twee uitbraken plaatsgevonden bij gehouden varkens op bedrijven in het westen en zuiden van Duitsland, waaronder één relatief dichtbij de grens met Nederland. Beide uitbraken in het westen en zuiden van Duitsland zijn beperkt gebleven tot enkel het index bedrijf; er heeft geen verdere verspreiding plaatsgevonden. In 2024 is in Duitsland in een nieuwe regio AVP aangetoond in het grensgebied van drie deelstaten (Hessen, Rheinland-Paltz en Baden-Würtemberg). Hier is AVP bij zowel gehouden als wilde zwijnen gevonden en die uitbraak is nog gaande. Langs de Rijn is in december 2024, stroomafwaarts van dit gebied, een kadaver van een besmet wild zwijn gevonden.
In 2024 komt AVP in Italië in vijf gebieden voor: op Sardinië, in Zuid Italië in Calabrië en in Campania, in Midden Italië rondom Rome en in Noord Italië tussen Genua en Milaan. Sardinië was bekend met een endemische situatie voor AVP genotype 1, waar momenteel geen meldingen meer van zijn, en in 2023 is daar een introductie met AVP genotype 2 (van de huidige pandemie) bijgekomen. Uitbraken in Italië kunnen via deze website (met officiële informatie van IZSLER) worden gevolgd.
Op basis van de ervaringen in België, Zweden, Italië en de uitbraken in het westen en zuiden van Duitsland, blijkt het goed mogelijk om, wanneer wilde zwijnen in het gebied besmet zijn, AVP insleep op varkensbedrijven te voorkomen.
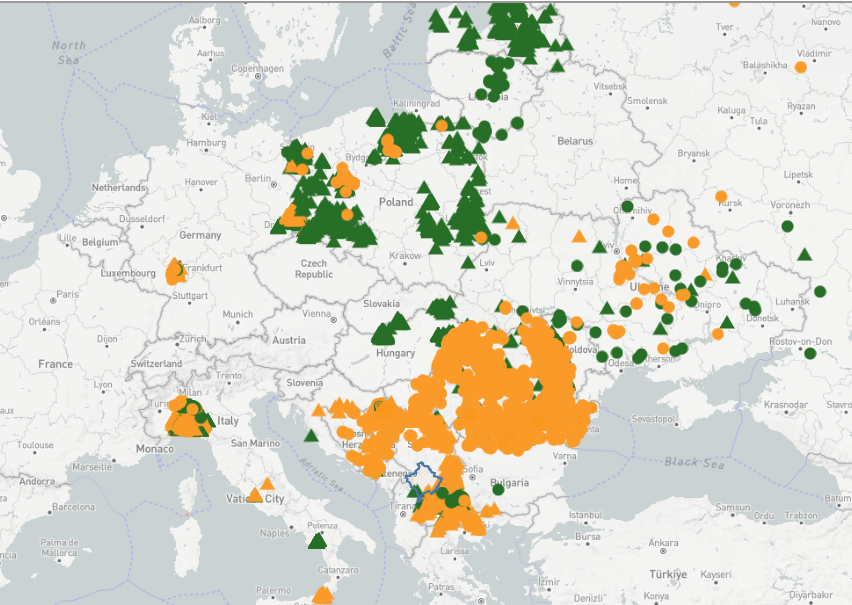

Overzicht actuele situatie 5-12-2024
Buiten Europa
Sinds 2018 is de ziekte vastgesteld in China en andere Aziatische landen, waaronder Vietnam, Cambodja, de Filippijnen, Vietnam, Laos, Cambodja, Myanmar, Oost-Timor en Noord- en Zuid-Korea en Indonesië.
AVP is gerapporteerd in nagenoeg alle landen ten zuiden van de Sahara.
In Afrika komt van oudsher ook AVPV genotype 1 voor, waar de zachte teek (Ornithodoros spp.) het boszwijn en het wrattenzwijn een belangrijke rol spelen in de epidemiologie van AVP. AVPV vermeerdert en verspreidt zich tussen de bos- en wrattenzwijnen, maar ook in de zachte teek.
Regelgeving
Nederlands recht
Animal Health Regulation (AHR). AVP valt onder de besmettelijke dierziekten categorie A van de AHR. Hiervoor gelden regels ter bestrijding (transport, aan- en afvoeren, insemineren, destructie en dergelijke). Verdenkingen dienen gemeld te worden bij de NVWA-ambtenaar. Melden kan via telefoon naar het Landelijk meldpunt dierziekten (045) 546 31 88.
Toezicht en opsporing: meewerken met de NVWA-ambtenaar is verplicht.
Europees recht
Op basis van de Animal Health Law (EU/2016/429) en de uitvoeringsverordening EU/2018/1882 is AVP ingedeeld als categorie A, D en E binnen de AHR. Vanaf 2023 is uitvoerings-verordening EU/2023/594 van toepassing welke de maatregelen beschrijft ter bestrijding van Afrikaanse Varkenspest. Naast algemene regels omtrent dierziekte preventie en controle (EU/2020/687) gelden er voor AVP derhalve speciale controle maatregelen.
Er zijn gebied-specifieke maatregelen, gebaseerd op de actuele epidemiologische situatie voor AVP in gebieden van lidstaten waar AVP aanwezig is. De gebieden worden aangeduid als Zone I, II of III, volgens de uitvoeringsverordening EU/2023/594 (zie boven) en in actuele EU verordening specifiek met naam benoemd. Voor de gebieden kunnen specifieke regels ten aanzien van transport van levende dieren of varkensproducten gelden en aanvullende bioveiligheidseisen. Een actuele kaart van aangewezen gebieden met beperkingen is te vinden op de website van de Europese Commissie. Een meer interactieve versie is beschikbaar via deze link.
Internationaal
AVPV is een zogenaamde ‘WOAH’-lijst ziekte. Voorheen heette dergelijke ziekten OIE-lijst-A ziektes, maar die onderverdeling in lijst A of B ziekte is niet meer van toepassing.
Op basis van de WOAH regelgeving is het verplicht voor de nationale veterinaire autoriteiten om een geval van AVPV tijdig te melden bij de WOAH. Landen mogen zelf en vrijwillig zichzelf ‘vrij’ verklaren van AVP (bron: WOAH.org).
De ‘Terrestrial Animal Health code’ en 'Terrestrial Animal Health Manual’ beschrijven de WOAH gestandaardiseerde methoden voor diagnostiek en surveillance, preventieve maatregelen en interventies van algemene maar ook specifieke ziekten, waaronder AVPV.
Aanpak besmette bedrijven
Vaccinatie
Er is momenteel geen geregistreerd vaccin tegen AVPV beschikbaar in Europa.
Wereldwijd zijn enkele farmaceuten en consortia bezig met het ontwikkelen van een vaccin dat na infectie met veldvirus zowel de ontwikkeling van klinische verschijnselen voorkomt, maar vooral ook de virusuitscheiding voldoende vermindert dat verspreiding effectief wordt geremd. Vaccins op basis van afgedood virus blijken onvoldoende effectief en vaccins op basis van verzwakte virus zijn vooralsnog onvoldoende veilig gebleken. Recombinant deletie vaccins, waar bepaalde genen niet tot expressie komen, Recombinant deletie vaccins, waar bepaalde genen niet tot expressie komen, zijn momenteel het meest veelbelovend (experimental recombinant live attenuated viruses (LAVs); Bosch-Camós, et al. 2020).
Antibiotica
Antibiotica zijn tegen AVP niet werkzaam.
Overige maatregelen
De bestrijding van AVP bij gehouden varkens gebeurt onder regie van de NVWA en het ministerie van LNV. Hiervoor is een draaiboek beschikbaar (versie 2018). De bestrijding van een uitbraak van AVP bij wilde zwijnen is ook beschreven. (NVWA/Afrikaanse varkenspest)
In geval van een uitbraak is vooralsnog de enige optie het toepassen van 'stamping-out'. Dit betekent het doden van alle varkens aanwezig op de locatie.
In de eerste 72 uur na detectie van een geval wordt een algehele ‘stand-still’ (bezoek- en transportverbod van dieren, voer en mest) afgekondigd om verdere verspreiding te verminderen, snel een inschatting te kunnen maken hoe dieren op de locatie besmet zijn geraakt (introductie) en hoe ver het heeft kunnen spreiden voordat het ontdekt is. Dit wordt het traceringsonderzoek genoemd. De uitkomsten van het traceringsonderzoek kunnen aanleiding zijn om nadere maatregelen te treffen op contactbedrijven en/of in bepaalde gebieden. In principe geldt dat bij een uitbraak van AVP geen preventieve ruimingen worden voorzien, maar de epidemiologische situatie ten tijde van een uitbraak kan aanleiding zijn voor een andere aanpak.
Opsporen en afvoeren besmette dieren
Uitbraak onder gedomesticeerde dierenBij een uitbraak van AVP worden alle aanwezige varkens op de locatie gedood. Dit heeft tot doel de verspreiding naar andere locaties te voorkomen.
De belangrijkste verspreider van AVP is het varken. De aanvoer van varkens is daarom het grootste risico. Bij een uitbraak in een naïef bedrijf is de transmissie binnen het hok hoog (R0 = 5), maar tussen de hokken laag (R0 = 0.5-2.7) (Depner, et al. 2017).
Bij hoog-virulente varianten van AVP zal de kliniek en sterfte relatief eenvoudig kunnen wijzen op AVPV. Echter bij mild-virulente varianten kunnen verschijnselen mild zijn en eenvoudig verward worden met andere ziekten. Samen met de incubatieperiode van ~4 dagen is recent beschreven dat de tijd tot detectie op een bedrijf, in geval van een milde stam, eenvoudig kan oplopen tot 14 dagen.
In 2023 heeft de Europese commissie uitvoeringsverordening EU/2023/594 gepubliceerd waarin een gebiedsgerichte aanpak of regionalisering in geval van uitbraak van AVP bij gedomesticeerde en/of bij wilde zwijnen wordt vastgesteld. In de regeling worden twee definities van beperkingszones, te weten beschermings- en bewakingszones, gebruikt. Beperkingszones kunnen worden onderverdeeld in zone I, II, en III. Beperkingszones zijn van toepassing in geval van uitbraken bij gehouden varkens. Een besmette zone wordt ingesteld bij een uitbraak in wilde zwijnen (art. 3).
Art 7 van de verordening is van groot belang omdat hier en in samenhang met EECU/2020/687, beschreven is dat in geval een uitbraak bij gehouden varkens zich beperkt tot een enkel geval de ingestelde regels minder lang van toepassing zijn en enkel voor het betreffende gebied.
In bijlage 1 van de verordening 2023/594 worden per lidstaat alle beperkingszones I, II, en III binnen de Europese Unie beschreven, wat van belang is voor handel en transport.
De maatregelen uit de EU verordening 2023/594 is ook in Nederlandse wetgeving verankerd in de Regeling Veterinaire maatregelen specifieke dierziekten of zoönosen (hoofdstuk 2).
Uitbraak onder wilde zwijnen
De bestrijding van een uitbraak van AVP bij wilde zwijnen is beschreven door het ministerie van LNV, maar de basis voor een toekomstige bestrijding is vastgelegd in de AHR (EU/2016/429). In 2023 is EU uitvoeringsverordening EU/2023/594 gepubliceerd waarin een gebiedsgerichte aanpak in geval van uitbraak van AVP is vastgesteld. De gebiedsgerichte aanpak heeft tot doel de verspreiding van AVP onder de wilde varkens te verminderen en verspreiding naar gehouden varkens te voorkomen. Een besmet gebied zal worden afgesloten zodat wilde varkens het gebied niet uit kunnen en karkassen van dode dieren moeten worden verwijderd. Overige maatregelen zijn ter beoordeling aan de autoriteiten op dat moment.
Algemene maatregelen
Maatregelen in het kader van de volksgezondheid
AVP is geen zoönose en ten behoeve van de volksgezondheid zijn geen aanvullende maatregelen nodig. AVP onder gedomesticeerde varkens kan door de letaliteit alsmede door de bestrijdingsmaatregelen èn zware handelsbeperkingen leiden tot ernstige verstoring van de voedselketen waardoor het aanbod van vers varkensvlees aan de consument wordt verminderd.
Preventie
Bekijk de video's:
Voorkomen van introductie in Nederland
In de Afrikaanse landen, waar AVP endemisch is, is de ziekte lastig te bestrijden. AVP is lastig te eradiceren, vanwege meerdere redenen: endemische infectie in lokale zwijnen populaties; het ontbreken van vaccins; het veelal ontbreken van goede diagnostische mogelijkheden; en het veelal onvoldoende functioneren van lokale veterinaire diensten.In Europa is AVP beter te bestrijden, maar vooralsnog is de epidemie niet tot staan gebracht, mede door endemische infecties in wilde zwijnen populaties in bosrijke gebieden. Uitbraken in het westen van Europa zijn tot op heden beperkt gebleven tot een enkel bedrijf of enkele infecties in wilde zwijnen. Het blijkt daarmee wel mogelijk om insleep van AVP naar gehouden varkens te voorkomen.
De basis voor preventieve bioveiligheid maatregelen ligt op het vermijden van contact van varkens met mogelijk geïnfecteerde varkens, geïnfecteerd dierlijk materiaal of gecontamineerde transportmiddelen of materialen. Hieronder staan de belangrijkste generieke adviezen;
Voor varkensbedrijven
De CoViVa heeft een AVP preventiescan gemaakt waarbij eenvoudig een overzicht wordt verkregen van de goede en de verbeterpunten ten aanzien van de risico’s op de insleep van AVP. Voorkomen van direct contact: Voer geen dieren aan van besmette bedrijven of uit besmette gebieden. Voorkom contact tussen gehouden varkens en wilde varkens, met name van belang voor varkens met uitloop. Voorkomen van indirect contact: Hanteer een goed schone/vuile weg principe. Er dient een scheiding te zijn in schone/vuile weg met fysieke afscheiding. Transportmiddelen van buiten komen niet op de schone weg en zijn gereinigd en ontsmet voor aankomst. Bezoekers dienen bedrijfskleding en -schoeisel te dragen. De transporteur mag niet in of nabij de stal komen en werknemers komen niet op de vuile weg, ook niet om kadavers of voer te transporteren.Consequent niet voederen van varkens met keukenafval (swill), ook geen restjes worst of vleeswaren van de lunch. Immers, vlees en vleesproducten van besmette varkens kunnen langdurig infectieus blijven. Bezoekers die jagen worden extra vragen gesteld en indien nodig extra hygiënemaatregelen opgelegd. Voorkom gebruik van niet gereinigde en -gedesinfecteerde materialen die elders zijn gebruikt. Zorg voor goede reiniging en ontsmetting van materialen, maar ook zakgoed e.d. bij aanvoer op het bedrijf. Veevoer wordt bij voorkeur niet uit AVP risico gebieden betrokken. Het erf en opslagplekken voor veevoer of bedding zijn niet toegankelijk voor wilde varkens, maar ook niet voor transport vanaf het vuile gedeelte. Huisdieren zouden geen toegang moeten hebben tot de stallen en ongediertebestrijding dient adequaat en professioneel te worden uitgevoerd. Wees alert op ziekteverschijnselen en (verhoogde) sterfte van varkens op uw bedrijf. Bij twijfel altijd uw dierenarts raadplegen of direct contact opnemen met het meldpunt.
Voor reizigers
Neem geen vleesproducten mee uit landen waar het virus endemisch aanwezig is. Dit verbod moet worden nageleefd en gecontroleerd op relevante inreisplaatsen (luchthavens of havens). Deponeer afval altijd in de daartoe bestemde afvalbakken die goed afsluitbaar zijn. Indien afvalbakken vol zijn of openbare ruimtes niet schoon zijn gooi het afval later weg in afvalbakken die wel goed afsluitbaar en schoon zijn. Meld vervuiling van de openbare ruimtes via de Buiten Beter App
Huidige surveillance in Nederland
Gehouden varkens
In Nederland vindt een continue surveillance plaats op onder andere AVP met de volgende acties:
- Dierenartsen en veehouders zijn elke dag alert op mogelijke verschijnselen van AVP. Er is een meldplicht bij elke verdenking van een besmettelijke dierziekte, waaronder AVP.
- Dierenartsen bezoeken varkensbedrijven minimaal elke maand voor een klinische inspectie. Bevindingen worden vastgelegd in de OnlineMonitor en de ingevoerde gegevens worden periodiek geanalyseerd op signalen die kunnen wijzen op een uitbraak die niet herkend is als zodanig door veehouder of dierenarts.
- Early warning diagnostiek door de praktiserend dierenarts: 6 bloedmonsters (EDTA); deze kunnen worden onderzocht op AVP en klassieke varkenspest (KVP), middels PCR onderzoek. Een overleg met NVWA is niet noodzakelijk (maar mag wel) en het bedrijf wordt niet geblokkeerd als deze monsters worden opgestuurd. Het onderzoek is gratis, enkel de dierenarts rekent mogelijk kosten door voor monstername en verzenden van monsters. Bij een negatieve uitslag (geen AVP aangetoond) volgen er geen consequenties. Bekijk: Factsheet Diagnostiek AVP en KVP | Publicatie | NVWA (Stand: 22-12-2023.)
- De kadavers die worden aangeboden voor pathologisch onderzoek bij GD worden uitgebreid bekeken voor mogelijke aanwijzingen van AVP of KVP. Tonsillen van alle bij GD aangeboden varkens worden doorgestuurd naar WBVR voor een PCR test op AVP. In geval van een verdenking van AVP op basis van bevindingen door de patholoog wordt een melding gedaan bij de NVWA en wordt het bedrijf geblokkeerd totdat uitslag van nader onderzoek negatief is. De uitslag is er vrijwel altijd binnen een dag en bij een negatieve uitslag worden beperkingen direct opgeheven. Tonsillen van dieren aangeboden ter sectie bij GD worden sinds herfst 2022 routinematig onderzocht op AVP bij WBVR.
Wilde zwijnen
Wanneer dode wilde varkens worden gevonden kan dit worden gemeld bij de Faunabeheereenheid (opzichter). Wanneer hier specifieke aanleiding voor is worden monsters genomen en opgestuurd naar WBVR voor uitsluiting van AVP. Het kadaver wordt totdat de uitslag bekend is niet verplaatst.
Jagers zijn alert op verschijnselen van AVP tijdens de jacht en bij het onderzoek van het geschoten dier. Steekproefsgewijs worden kadavers onderzocht op aanwezigheid van AVP.
Websites en literatuur
Websites
- World Organisation for Animal Health (http://www.woah.org) (voorheen OIE)
- WOAH Terrestrial Manual Chapter 3.18 on ASF
- WOAH Terrestrial Code Chapter 15.1 on ASF
- ASFv specifieke pagina van WOAH: African swine fever
- Food and Agricultural Organisation (http://www.fao.org)
- Europese Commissie; website over AVPV met actuele informatie en Europese regelgeving
- European Food Safety Authority (EFSA); Interactieve website over AVP van EFSA met actuele informatie
- NVWA pagina over AVP
- Wageningen UR – WBVR pagina over AVP
- Dutch Wildlife Health Center pagina over AVP
- Friedrich Loefler Instituut, Duitsland dossier over AVP
- Center for Food and Public Health van Iowa State University (USA) dossier over AVPV
- DEFRA (United Kingdom)- how to recognize ASFv
- Ornithodorus spp. - current known distribution: May 2020 (europa.eu)
- Draaiboek uitbraak AVP gehouden varkens
- NVWA 'Lijst toegelaten ontsmettingsmiddelen R&O AVP'
- Website van het Ctgb (College voor de toelating van gewasbeschermingsmiddelen en biociden)
Literatuur
- Bosch-Camós, L., López, E., & Rodriguez, F. (2020). African swine fever vaccines: a promising work still in progress. Porcine health management, 6, 17.
- Cackett, G., Matelska, D., Sýkora, M., Portugal, R., Malecki, M., Bähler, J., ... & Werner, F. (2020). The African swine fever virus transcriptome. Journal of virology, 94(9), e00119-20.
- de Carvalho Ferreira, H. C., Weesendorp, E., Quak, S., Stegeman, J. A., & Loeffen, W. L. A. (2013). Quantification of airborne African swine fever virus after experimental infection. Veterinary Microbiology, 165(3-4), 243-251.
- de Carvalho Ferreira, H. C., Zúquete, S. T., Wijnveld, M., Weesendorp, E., Jongejan, F., Stegeman, A., & Loeffen, W. L. (2014). No evidence of African swine fever virus replication in hard ticks. Ticks and tick-borne diseases, 5(5), 582-589.
- Depner, K., Gortazar, C., Guberti, V., Masiulis, M., More, S., ... & Dhollander, S. (2017). Epidemiological analyses of African swine fever in the Baltic States and Poland:(Update September 2016–September 2017). EFSA Journal, 15(11).
- Eblé, P. L., Hagenaars, T. J., Weesendorp, E., Quak, S., Moonen-Leusen, H. W., & Loeffen, W. L. A. (2019). Transmission of African Swine Fever Virus via carrier (survivor) pigs does occur. Veterinary microbiology, 237, 108345.
- ECDC – European Centre for Disease Prevention and Control (2020). Ornithodorus spp. - current known distribution: May 2020. Link: https://www.ecdc.europa.eu/en/publications-data/ornithodorus-spp-current-known-distribution-may-2020 (Stand 22-12-2023).
- EFSA Panel on Animal Health and Welfare (AHAW). (2014). Scientific opinion on African swine fever. EFSA Journal, 12(4), 3628.
- Gallardo, M. C., Reoyo, A. T., Fernández-Pinero, J., Iglesias, I., Muñoz, M. J., & Arias, M. L. (2015). African swine fever: a global view of the current challenge. Porcine health management, 1, 21.
- Kolbasov, D., Titov, I., Tsybanov, S., Gogin, A., & Malogolovkin, A. (2018). African swine fever virus, Siberia, Russia, 2017. Emerging infectious diseases, 24(4), 796.
- Lamberga, K., Oļševskis, E., Seržants, M., Bērziņš, A., Viltrop, A., & Depner, K. (2020). African Swine Fever in Two Large Commercial Pig Farms in LATVIA-Estimation of the High Risk Period and Virus Spread within the Farm. Veterinary sciences, 7(3), 105.
- Malladi, S., Ssematimba, A., Bonney, P. J., St Charles, K. M., Boyer, T., Goldsmith, T., ... & Culhane, M. R. (2022). Predicting the time to detect moderately virulent African swine fever virus in finisher swine herds using a stochastic disease transmission model. BMC Veterinary Research, 18(1), 1-9.
- Malogolovkin, A., Burmakina, G., Titov, I., Sereda, A., Gogin, A., Baryshnikova, E., & Kolbasov, D. (2015). Comparative analysis of African swine fever virus genotypes and serogroups. Emerging Infectious Diseases, 21(2), 312.
- Nielsen, J. P., Larsen, T. S., Halasa, T., & Christiansen, L. E. (2017). Estimation of the transmission dynamics of African swine fever virus within a swine house. Epidemiology & Infection, 145(13), 2787-2796.
- OIE Technical Disease Card AFRICAN SWINE FEVER, 2019. Link: https://www.woah.org/app/uploads/2021/03/african-swine-fever.pdf (Stand 22-12-2023).
- Rowlands, R. J., Michaud, V., Heath, L., Hutchings, G., Oura, C., Vosloo, W., ... & Dixon, L. K. (2008). African swine fever virus isolate, Georgia, 2007. Emerging infectious diseases, 14(12), 1870.
- Salas, M. L., & Andrés, G. (2013). African swine fever virus morphogenesis. Virus research, 173(1), 29-41.
- Salguero, F. J. (2020). Comparative pathology and pathogenesis of African swine fever infection in swine. Frontiers in Veterinary Science, 7, 282.
- Sánchez‐Vizcaíno, J. M., Laddomada, A., & Arias, M. L. (2019). African Swine Fever Virus. In Zimmerman, J. J., Karriker, L. A., Ramirez, A., Schwartz, K. J., Stevenson, G. W., & Zhang, J. (Eds.), Diseases of swine (Vol. 11, pp. 443-452). Hoboken, USA: John Wiley & Sons, Inc.
- Qu, H., Ge, S., Zhang, Y., Wu, X., & Wang Z. (2022). A systematic review of genotypes and serogroups of African swine fever virus. Virus Genes, 58(2), 77-87.
Foto's klinische beelden
African swine fever kills pigs
World Organisation for Animal Health
African swine fever (ASF) is a deadly disease affecting wild and domestic pigs. It is not a danger to human health but it can be devastating for farming economy. Moreover, the virus is highly resistant in the environment and in contaminated pork products, meaning that human carelessness can spread the disease. Travelling? Hunting? Working with pigs? Commercialising pigs or pork products? Learn in this video the precautionary measures that you must take to avoid being the carrier of this deadly pig disease.
ASF: How to stay one step ahead
European Food Safety Authority
EFSA’s new practical guide on African swine fever: what it is and how to protect domestic pigs from infection. From causes and symptoms to precautionary measures, a list of best practices on how to protect farm animals and wild boar populations from ASF.