- Home
- Diergezondheid
- Dierziekten
- Japanese-Encephalitis
Japanese Encephalitis
Het Japanse Encephalitisvirus (JEV) is een arbovirus (arthropod transmitted virus) en behoort tot het genus Flavivirus in de familie Flaviviridae. JEV heeft maar een serotype, maar er zijn twee subtypes bekend (Nakayama en JaGar-01). JEV is sterk verwant aan St. Louis encephalitis virus, Murray Valley encephalitis virus en West Nile virus (behoren allemaal tot het JE-serocomplex). Deze virussen vormen samen met nog een paar andere virussen de Japanese encephalitis serogroup binnen de flavivirussen. Het bekendste Flavivirus is het Gele Koortsvirus (flavus = goudgeel). Het genus Flavivirus is georganiseerd in acht complexen op basis van antigene eigenschappen. Naast het JE-serocomplex bestaat bijvoorbeeld ook het Dengue-serocomplex.
Veterinair kennisdossier Japanese Encephalitis
- Verschijnselen
- Diagnose
- Prevalentie
- Aanpak besmette bedrijven
- Preventie
- Regelgeving
- Websites en literatuur
De kiem


Waarschijnlijk verliezen deze virussen buiten de (levende) gastheer snel hun infectiviteit. Van JEV zijn vijf genotypen te onderscheiden, waarvan genotype I in Azië het meest voorkomt. Er bestaat echter een dynamische situatie waarbij in een bepaald land of regio het ene genotype het andere kan verdringen (genomic shift). Genotypen I en III zijn meer geassocieerd met epidemische uitbraken en II en IV meer met endemische ziekte in vooral Zuidoost-Azië. In de laatste 30 – 40 jaar is er echter een verschuiving opgetreden van genotype III naar genotype I. Een recente studie heeft aangetoond dat mutaties in de NS2B/NS3 genen hiervoor mede verantwoordelijk zijn. Het lijkt erop dat genotype I virussen niet zozeer beter repliceren in muggen, maar wel leiden tot een snellere en hogere viraemie in varkens, jonge eenden en kuikens. Daarmee zouden deze virussen een epidemiologisch voordeel hebben op genotype III virussen. Karna et al (2019) publiceerden echter precies omgekeerde resultaten (genotype I geeft meer verspreiding via vectoren en geen verschil in viraemie in jonge eenden), dus het laatste woord is hier nog niet over gezegd. Aangezien de meeste vaccins op genotype III gebaseerd zijn roept dit ook nog wel wat vraagtekens op over de effectiviteit van vaccinaties.

Gevoelige diersoorten
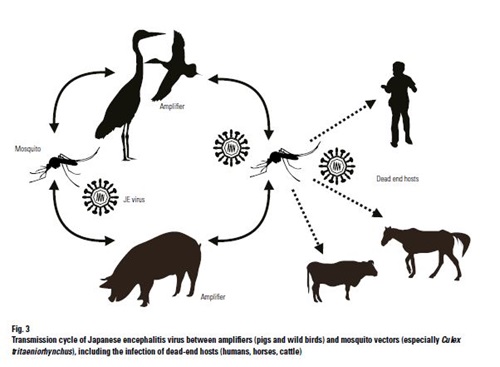
Veel diersoorten en de mens zijn gevoelig voor JEV. Vooral paarden, ezels, runderen, varkens en mensen worden ziek. Bij paarden, ezels, runderen en mensen gaat het daarbij vooral om neurologische symptomen terwijl bij varkens voornamelijk abortus of doodgeboorte optreedt. Het virus kan ook andere gedomesticeerde dieren besmetten, zoals schapen, geiten, honden, katten, in het wild levende zoogdieren, reptielen, amfibieën en vogels. Bij deze dieren verloopt de besmetting echter praktisch altijd symptoomloos. Vogels, vooral reiger- en ooievaarsoorten, en varkens zijn de belangrijkste reservoirs van het virus
Volksgezondheid
De mens is gevoelig voor JEV. In delen van Azië is JE de belangrijkste veroorzaker van virale encephalitis bij mensen. Wereldwijd worden ongeveer 70.000 gevallen per jaar gerapporteerd met daaruit voortvloeiend ongeveer 10.000 sterftegevallen. Hierbij is waarschijnlijk sprake van onderrapportage. In de meer gematigde klimaatzones treden de humane infecties met name op in de nazomer en herfst en voornamelijk op het platteland. In tropische gebieden kunnen de infecties het hele jaar optreden. Symptomen zijn over het algemeen ernstiger bij kinderen en ouderen. De meeste humane infecties verlopen echter symptoomloos: ongeveer 1 op de 500 infecties leidt tot klinische verschijnselen (in sommige uitbraken echter 1 op de 25!). Bij mensen is de incubatietijd 6 tot 14 dagen en de eerste verschijnselen zijn weinig specifiek (koorts, rillingen, spierpijn, ernstige hoofdpijn en braken). Daarna treden bij een deel van de patiënten neurologische verschijnselen op (nekstijfheid, verlaagd bewustzijn overgaand in coma, epileptische aanvallen, verlammingen en trillingen. Vervolgens zal 15 tot 30% van de patiënten met neurologische verschijnselen overlijden, terwijl bij ongeveer 50% van de overlevenden permanente restverschijnselen overblijven.
Overleving
Het virus overleeft niet lang buiten de gastheer. In muggen, reptielen, amfibieën en vleermuizen kan het virus mogelijk overwinteren (het overwinteringsmechanisme is niet volledig opgehelderd). Transmissie vindt vrijwel uitsluitend plaats door geïnfecteerde muggen. Overdracht door teken is een enkele keer beschreven. Rechtstreekse besmetting van paarden onderling is nooit beschreven maar overdracht van paard naar paard is soms wel mogelijk via muggen. Over het algemeen is de viraemie bij paarden daar echter niet hoog genoeg voor, daarom wordt het paard als een eindgastheer (betere benaming is een dead-end host) beschouwd. Wel is onderlinge rechtstreekse besmetting tussen vogels en tussen alligators gerapporteerd. De gangbare cyclus is tussen vogels en/of varkens en muggen. JEV-uitbraken komen het meest voor in de nazomer als JEV zich vermeerdert in jonge vogels en vervolgens via muggen overgebracht wordt naar zoogdieren zoals varkens. Het varken is ook een belangrijke vermeerderaar en daarmee reservoir van het virus. Ook wilde zwijnen kunnen dus een rol spelen in de verspreiding, zoals in 2008 in Japan werd aangetoond. Daarnaast is na experimentele infecties van varkens (needle challenge) ook rechtstreekse oronasale overdracht naar contactvarkens aangetoond.
De belangrijkste verspreidende mug is Culex tritaeniorhynchus. Deze mug voedt zowel op vogels als op zoogdieren. Andere muggensoorten kunnen eveneens JEV overdragen, zoals Cx. pipiens quinquefasciatus, Cx. tarsalis, Aedes albopictu en, Ochleratus japonicus. Deze muggensoorten komen ook voor op het westelijk halfrond. Het is dus zeer wel mogelijk dat JEV zich buiten Azië kan verspreiden. JEV zou ook door teken overgebracht kunnen worden (experimenteel aangetoond).
Desinfectie
Desinfectie is niet van groot belang omdat het virus niet lang overleeft buiten een gastheer en normaliter niet rechtstreeks wordt overgedragen. In het laboratorium of in andere situaties waarin desinfectie noodzakelijk is kan het virus worden geïnactiveerd met 70% alcohol, 2% glutaaraldehyde, 3 tot 8% formaldehyde, natrium hypochloriet, iodoforen, etcetera, en door verhitting, UV en gammastraling.
Verschijnselen van JEV
Klinisch beeld
De meeste infecties bij paarden verlopen subklinisch of symptoomloos. De symptomatische infecties variëren in ernst.
Klinische verschijnselen
Sommige paarden vertonen lichte ziekteverschijnselen met voorbijgaande koorts, anorexie, lethargie en congestie of geelverkleuring van de slijmvliezen. Dit syndroom duurt slechts enkele dagen en het paard herstelt zonder complicaties. Andere paarden ontwikkelen echter een encefalitis. In milde gevallen is het paard lethargisch en anorectisch met fluctuerende koortspieken en neurologische verschijnselen zoals incoördinatie, slikbezwaren, voorbijgaande nekstijfheid, overgevoeligheid van hoofd en nek, fotofobie, tremoren, radialis paralyse of blindheid. Geelzucht en puntbloedingen kunnen worden gezien op de slijmvliezen. Deze paarden herstellen meestal binnen een week. Een ernstigere vorm, ‘hyperexcitatievorm’ genoemd, wordt gekenmerkt door hoge koorts, dwangbewegingen, agressief of depressief gedrag, perioden van blindheid, hevig zweten en spiertrillingen. Hoewel sommige paarden herstellen, sterven de meeste dieren binnen een tot twee dagen. Deze hyperexcitatievorm is ongewoon en betreft meestal minder dan 5% van de zieke paarden. In sommige paarden kunnen neurologische verschijnselen zoals ataxie aanwezig blijven na herstel. Bijna alle paarden met ernstige neurologische verschijnselen sterven binnen twee weken na het optreden van de eerste ziekteverschijnselen.
Bij varkens wordt JEV met name gekarakteriseerd door reproductieproblemen. Het meest voorkomende symptoom is de geboorte van dode biggen of gemummificeerde foeten, meestal vindt de geboorte a terme plaats. Geïnfecteerde biggen die levend geboren worden laten vaak tremoren en convulsies zien. Ook treedt soms abortus op. Bij beren treedt soms verstoring van de spermatogenese op, leidend tot tijdelijke of permanente infertiliteit.
Bij de mens verloopt de infectie meestal a-symptomatisch. In minder dan 1% van de infecties ontstaat een encephalitis die fataal kan aflopen, zeker bij jonge kinderen. Na herstel kunnen wel problemen aanwezig blijven door aantasting van het centraal zenuwstelsel (doofheid, emotionele labiliteit en hemiparesis).
Incubatieperiode
De incubatieperiode is 8 tot 10 dagen.
Morbiditeit/mortaliteit
De mortaliteit is laag. In de gematigde gebieden in Azië begint het seizoen van JEV bij watervogels in mei of juni en eindigt in september of oktober. Humane en equine gevallen worden vooral gezien in de nazomer en in de herfst. In tropische gebieden circuleert het virus het gehele jaar in muggen, vogels en varkens, en hangen de pieken vooral af van regenval of irrigatie. In sommige tropische gebieden worden epidemieën gezien aan het einde van het regenseizoen. Vooral jonge biggen zijn zeer gevoelig voor infectie en vormen daarom de belangrijkste bron van vermeerdering van het virus en dus voor besmetting van paarden en mensen. In Japan is 50 tot 70% van de (wilde + traditioneel gehouden) varkens besmet.
Uitscheiding en verspreiding van de kiem
Transmissie vindt vrijwel uitsluitend plaats via geïnfecteerde muggen. Er zijn enkele humane gevallen beschreven (laboratoriuminfecties) tijdens het verzamelen van weefsels. Verder kan het virus worden overgedragen via inademing van aerosolen (incidenteel bij hoge concentraties) en middels beschadigingen in de huid en slijmvliezen of per injectie. Mensen en paarden worden als dead-end hosts gezien, varkens spelen een belangrijke rol in bepaalde gebieden omdat ze het virus vermeerderen en daarmee naast vogels een belangrijk reservoir voor het virus vormen. Omdat varkens van de gedomesticeerde diersoorten het belangrijkste reservoir zijn, kan een serologisch prevalentieonderzoek onder varkens en SMEDI (stillbirth, mummification, embryonic death, infertility) syndroomsurveillance in varkens de humane besmettingen voorspellen.
Differentiaaldiagnostiek
Bij paarden:
- EHV1 myeloencephalopathie
- Hepatische encephalopathie
- Bacteriële of toxische encephalitis
- Equine protozoaire myeloencephalitis
- Rabiës
- Murray Valley encephalitis
- Western, Eastern en Venezuelan encephalitis
- WNV encephalitis
Bij varkens:
- PPV, PRRS, enterovirus, leptospirose;
- ZvA, KVP;
- Cytomegalovirus, toxoplasmose.
- Het seizoensgebonden karakter en de afwezigheid van symptomen bij de zeugen zelf zijn extra aanwijzingen voor JEV.
Diagnostiek van JEV
Pathologie
Bij paarden worden alleen aspecifieke laesies aangetroffen. Er zijn geen karakteristieke macroscopische laesies in de hersenen te zien. Bij microscopisch onderzoek kan een diffuse nonsuppuratieve encephalomyelitis vastgesteld worden, gekenmerkt door phagocytose van neuronen, perivasculaire cuffing en focale gliose. De bloedvaten zijn verwijd en bevatten talrijke mononucleaire cellen. Daarnaast kan zwelling van endotheelcellen en neuronen, degeneratie, necrose en gliosis worden aangetroffen, met name in de grote hersenen.
Bij varkens worden doodgeboren voldragen vruchten naast gemummificeerde vruchten aangetroffen. Daarnaast kunnen congenitale neurologische afwijkingen worden aangetroffen (hydrocephalus, cerebellaire hypoplasie en hypomyelinogenese van het ruggemerg).

Isolatie van de kiem
Virusisolatie is mogelijk in diverse celculturen:
- Vero-cellen
- Baby hamster kidney- cellen (BHK-cellen)
- Pig kidney-cellen (PK-cellen)
- C3/36 cellijn van de mug Aedes albopictus
- Ge-embryoneerde kippencellen
- Intracraniale of intraperitoneale inoculatie van babymuizen
Na optreden van cytopathogene veranderingen in de celkweek kan bevestiging van JEV plaatsvinden met behulp van HAR, ELISA, Virus Neutralisatie Test (VNT) of RT-PCR.
Virusisolatie bij zieke of dode paarden verloopt echter vaak negatief en tegenwoordig wordt daarom vooral RT-PCR en/of immuunhistochemie op weefsels van het centrale zenuwstelsel gebruikt.
Serologie
Antistoffen zijn aantoonbaar met HAR, VNT, ELISA en IFT, waarbij opgemerkt moet worden dat IgM-antilichamen vanaf twee dagen tot twee weken na infectie aantoonbaar zijn. In endemische gebieden moeten gepaarde sera genomen worden voor het stellen van een serologische diagnose (seroconversie dan wel significante titerstijging op basis van IgG antistoftesten). De diagnose kan ook redelijk betrouwbaar gesteld worden op basis van een hoge titer in het eerste monster, het aantonen van een IgM-respons in serum dan wel een IgM- en/of IgG-respons in cerebrospinale vloeistof. Maternale antistoffen zijn soms aantoonbaar tot een leeftijd van acht maanden. Kruisreactie met antistoffen tegen WNV is bekend -zeker in ELISA’s- en in gebieden waar beide virussen voorkomen moeten een positieve ELISA-uitslag bevestigd worden met de meer specifieke VNT of Plaque Reductie Neutralisatie Test (PRNT)
In Nederland wordt diagnostiek uitgevoerd op het Laboratorium voor exotische virus-infecties (LEVI), Erasmus MC-Virology Rotterdam en door het RIVM.
Prevalentie van JEV
Nederland
JEV komt (nog) niet voor in Nederland en in Europa, al zijn er recentelijk enkele JEV-sequenties gevonden in muggen in Italië die op JEV-introductie wijzen.
Andere landen
Landen buiten Europa:
De ziekte is endemisch in grote delen van Azië (zie kaartje waarop ook Italie staat aangegeven). Verspreiding naar andere delen van de wereld is echter niet uitgesloten gezien de geringe kieskeurigheid van het virus waar het gaat om de keuze van vector.

In endemische gebieden komen tienduizenden ziektegevallen (humaan) voor per jaar. In de periode 2010 tot 2017 werd Japanse Encephalitis gerapporteerd door de volgende landen: Afghanistan; Bahrain; Bangladesh; Bhutan; Brunei Darussalam; Cambodia; China (People's Rep. of); Chinese Taipei; Hong Kong (SAR - PRC); India; Indonesië; Iran; Iraq; Israël; Japan; Jordanië; Kazakhstan; Korea (Dem. People's Rep.); Korea (Rep. of); Kuwait; Kyrgyzstan; Laos; Libanon; Macau; Malaysia; Maldiven; Mongolië; Myanmar; Nepal; Oman; Pakistan; Palestijnse Autonome Gebieden; Filippijnen; Qatar; Saoedi Arabië; Singapore; Sri Lanka; Syrië; Tajikistan; Thailand; Timor-Leste; Turkmenistan; Verenigde Arabische Emiraten; Oezbekistan; Vietnam; Yemen.

Voor gedetailleerde informatie over de verspreiding zie: OIE: World Animal Health Situation en OIE bulletin (www.oie.int).
Aanpak besmette bedrijven
Vaccinatie
Voor zowel paarden als varkens als mensen zijn vaccins beschikbaar. In Azië zijn levende geattenueerde en geïnactiveerde vaccins commercieel verkrijgbaar. De vaccins beschermen tegen alle genotypes. In sommige landen worden alle kinderen routinematig gevaccineerd. In niet-endemische landen moeten laboratoriummedewerkers die met het virus werken gevaccineerd worden. Ook reizigers die naar endemische gebieden gaan, kunnen zich laten vaccineren voor vertrek. Vaccinatie van varkens kan helpen om humane en equine infecties te verminderen. Een kanttekening hierbij is dat in Zuid-Korea al 30 jaar een landelijke vaccinatie campagne voor varkens wordt toegepast (Anyang300: een levend geattenueerd vaccin), hetgeen zeer effectief blijkt te zijn ter voorkoming van klinische verschijnselen bij varkens, maar niet geleid heeft tot het voorkomen van humane uitbraken. Waarschijnlijk spelen grote watervogels zoals ooievaar- en reigersoorten in deze specifieke situatie een grotere rol als reservoir dan de varkens.

Antibiotica
Niet van toepassing.Overige maatregelen
Opsporen en afvoeren besmette dieren in geval van introductie in Nederland
Besmette paarden zijn niet direct infectieus voor de omgeving, al is ook voor paarden en runderen wel transmissie via muggen beschreven. Varkens en grote watervogels zoals ooievaars en reigers vormen echter het belangrijkste virusreservoir voor de muggen. Paarden dienen dus niet nabij varkens gehuisvest te worden. De muggen zijn nodig voor de transmissie. Paardenvliegendekens geïmpregneerd met permetrin kunnen de infectieoverdracht door muggen beperken. Ventilatoren in de stallen verlagen de muggendruk, evenals het bespuiten van de stalmuren met insecticiden. Opstallen kan het beste plaatsvinden voordat de schemering invalt en gedurende de nacht. De muggenactiviteit is het hoogst tussen zonsondergang en zonsopgang.
Algemene maatregelen in kader van volksgezondheid
Vaccinatie is al behandeld in paragraaf 5.1. Daarnaast zijn communicatie en publieksvoorlichting van groot belang. Deze communicatie dient zich te richten op algemene maatregelen ter voorkoming van vector-overdraagbare (in dit geval door muggen overdraagbare) ziekten. Deze adviezen zullen zich met name moeten richten op het reduceren van muggenpopulaties door het weghalen van alle bronnen met stilstaand water in en om het huis, het dragen van bedekkende kleding, het gebruikt van repellents zoals Deet en eventueel het gebruik van muskietennetten/klamboes en eventueel het toepassen van insecticiden in de directe omgeving (voor zover toegestaan binnen de Nederlandse wetgeving)
Preventie van JEV
Bedrijfshygiëne /insleeppreventie
Muggenbestrijding is in de praktijk moeilijk uitvoerbaar. Een aantal praktisch uitvoerbare (preventieve) maatregelen in de directe omgeving van mens en dier zijn behandeld in hoofdstuk 5.
Vaccinatie
Voor zowel mensen als varkens als paarden zijn vaccins beschikbaar. In Azië zijn levende geattenueerde en geïnactiveerde vaccins commercieel verkrijgbaar

China, Taiwan, Japan, Korea, Thailand:
- Routine-vaccinatieprogramma’s voor kinderen.
In andere JEV-endemische landen wordt slechts in beperkt mate gevaccineerd vanwege:
- onduidelijkheid incidentie
- hoge vaccinkosten
- gebrek aan kennis over morbiditeit en economische impact
- zorgen over bijwerkingen door allergische reacties bij geïnactiveerde op muizenhersencellen gekweekte vaccins
Regelgeving
Nederlands recht
JEV is een aangifteplichtige ziekte in Nederland volgens de Europese Diergezondheids Verordening (AHR). JE is ook een aangifteplichtige ziekte volgens de OIE (multiple species diseases).
Europees recht
JEV is een meldingsplichtige ziekte volgens de Europese diergezondheidsverordening (Animal Health Regulation AHR). Sinds 21 april 2021 valt het voorkomen en bestrijden van dierziekten namelijk onder deze Europese verordening. JE valt in categorie E.
De dierziekten in de Europese Diergezondheidsverordening zijn ingedeeld in de vijf categorieën A, B, C, D en E. Voor alle ziekten uit deze categorieën geldt een meldingsplicht, voor de ziekten uit categorieën A en B geldt daarnaast ook een bestrijdingsplicht.
- Dierziekten van categorie A zijn ziekten die niet in de Europese Unie voorkomen en die lidstaten meteen moeten uitroeien. Bijvoorbeeld mond-en-klauwzeer en varkenspest. Lidstaten moeten deze ziekten snel opsporen, direct bestrijden en besmette bedrijven en de directe omgeving afsluiten.
- Dierziekten van categorie B zijn ziekten die de Europese Unie wil uitroeien. Bijvoorbeeld tuberculose bij koeien, stieren en buffels. Lidstaten moeten deze ziekten daarom verplicht bestrijden. Lidstaten waar de ziekte niet voorkomt moeten maatregelen nemen om vrij te blijven van de ziekte.
- Dierziekten van categorie C zijn ziekten die minder besmettelijk zijn en die de Europese Unie wil indammen. Bijvoorbeeld de ziekte van Aujesky bij varkens en koeiengriep bij runderen. Lidstaten bepalen zelf of ze de ziekte willen uitroeien en of ze bij een uitbraak bedrijven afsluiten om verdere verspreiding te voorkomen.
- Dierziekten van categorie D zijn dierziekten die zich via internationale handelaren, vervoerders of reizigers verspreiden en die de Europese Unie wil indammen. Bijvoorbeeld abortus blauw bij varkens en verkoudheid (mycoplasma) bij kippen. Landen moeten voldoen aan Europese regels voor vervoer van en naar de EU en erbinnen.
- Dierziekten van categorie E zijn dierziekten die in de gaten gehouden moeten worden. Bijvoorbeeld Q-koorts bij geiten en paratuberculose bij runderen. Lidstaten moeten zich houden aan Europese regels om deze ziekten te melden.
JEV komt voor op de lijst van ‘goederen’ die zijn opgenomen in bijlage I bij Besluit 1999/193/GBVB van de Raad van 9 maart 1999 tot wijziging van Besluit 94/942/GBVB betreffende het Gemeenschappelijk optreden. Dit is door de Raad vastgesteld op grond van artikel J.3 van het Verdrag betreffende de Europese Unie, ten aanzien van de controle op de uitvoer van goederen voor tweeërlei gebruik.
Internationaal
Het verkeer van paarden binnen de EU en de invoer van paarden vanuit derde landen is geregeld in Richtlijn 90/426/EEG van de Raad van 26 juni 1990 tot vaststelling van veterinairrechtelijke voorschriften voor het verkeer van paardachtigen en de invoer van paardachtigen uit derde landen. Hierin staan alleen specifieke bepalingen voor Afrikaanse paardenpest, VEE, Dourine en kwade droes genoemd, zoals hieronder aangegeven. Wel kunnen volgens artikel 13 lid 2b aanvullende waarborgen geëist worden voor ziekten die in de Gemeenschap exotisch zijn.
Artikel 13 1. De paardachtigen moeten afkomstig zijn uit derde landen:
- welke vrij zijn van paardenpest;
- welke sedert twee jaar vrij zijn van Venezolaanse paardenencefalomyelitis (VEE);
- welke sedert zes maanden vrij zijn van dourine en van kwade droes.
2. Volgens de procedure van artikel 24 kan de Commissie
- beslissen dat lid 1 slechts voor een gedeelte van het grondgebied van een derde land geldt. In geval van regionalisering van de vereisten ten aanzien van paardenpest dienen ten minste de in artikel 5, leden 2 en 3, genoemde maatregelen in acht te worden genomen;
- aanvullende waarborgen eisen voor ziekten die in de Gemeenschap exotisch zijn.
Websites en literatuur
Websites
- www.oie.int
- www.ec.europa.eu
- http://www.rijksoverheid.nl/ministeries/ez
- www.nvwa.nl
- www.dierengezondheidszorg.be
- www.wur.nl
- www.defra.gov.uk/animal-diseases/
- http://www.fao.org/
- http://www.ec.europa.eu/
- http://www.cfsph.iastate.edu/
- http://www.vet.uga.edu/vpp/gray_book/fad/cbp.php
Literatuur
- Cleton N, Koopmans M, Braks M, van Maanen K and Reusken C. Japanese encephalitis in Southern Europe. Tijdschr Diergeneesk 2014; 139 (7): 20-25 1.
- Diagana M, Preux PM, Dumas M. Japanese encephalitis revisited. J Neurol Sci. 2007;262:165-70.
- Fan YC, Liang JJ, Chen JM, Lin JW, Chen YY, Su KH, Lin CC, Tu WC, Chiou MT, Ou SC, Chang GJ, Lin YL, Chiou SS. NS2B/NS3 mutations enhance the infectivity of genotype I Japanese encephalitis virus in amplifying hosts. PLoS Pathog. 2019 Aug 5;15(8)
- Guérin B, Pozzi N. Viruses in boar semen: detection and clinical as well as epidemiological consequences regarding disease transmission by artificial insemination. Theriogenology. 2005;63:556-72.
- Kahn CM, Line S, editors. The Merck veterinary manual [online]. Whitehouse Station, NJ: Merck and Co; 2003. Equine encephalomyelitis. Available at: http://www.merckvetmanual.com/mvm/index.jsp?cfile=htm/bc/100900.htm. Accessed 19 Nov 2007.
- Karna AK, Bowen RA. Experimental Evaluation of the Role of Ecologically-Relevant Hosts and Vectors in Japanese Encephalitis Virus Genotype
Displacement. Viruses. 2019 Jan 6;11(1). - Kitai Y, Shoda M, Kondo T, Konishi E. Epitope-blocking enzyme-linked immunosorbent assay to differentiate west nile virus from Japanese encephalitis virus infections in equine sera. Clin Vaccine Immunol. 2007;14:1024-31.
- Lian WC, Liau MY, Mao CL. Diagnosis and genetic analysis of Japanese encephalitis virus infected in horses [sic]. J Vet Med B Infect Dis Vet Public Health. 2002;49:361-5.
- Mansfield KL, Hernandez-Triana LM, Banyard AC, Fooks AR, Johnson N. Japanese encephalitis virus infection, diagnosis and control in domestic animals. Vet Microbiol 2017; 201: 85 – 92.
- Morita K, Nabeshima T and Buerano CC. Japanese encephalitis. Rev. Sci. Tech. Off. Int. Epiz. 2015: 34: 441-452
- Mackenzie JS, Gubler DJ, Petersen LR. Emerging flaviviruses: the spread and resurgence of Japanese encephalitis, West Nile and dengue viruses. Nat Med. 2004;10:S98-109.
- Oya A, Kurane I. Japanese encephalitis for a reference to international travelers. J Travel Med. 2007;14:259-68.
- Petersen LR, Marfin AA. Shifting epidemiology of Flaviviridae. J Travel Med. 2005;12:S3-11.
- Rosen L. The natural history of Japanese encephalitis virus. Annu Rev Microbiol. 1986;40:395-414.
- Tsai TF. Congenital arboviral infections: something new, something old. Pediatrics. 2006;117:936-9.
- World Organization for Animal Health [OIE] . Manual of diagnostic tests and vaccines for terrestrial animals [online]. Paris: OIE; 2004. Japanese encephalitis. Available at: http://www.oie.int/eng/normes/mmanual/A_00092.htm. Accessed 15 Nov 2007.