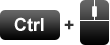- Home
- Diergezondheid
- Dierziekten
- Brucella-suis
Brucella suis
Brucellose bij varkens wordt voornamelijk veroorzaakt door de bacterie Brucella suis (B. suis), maar bijvoorbeeld ook door Brucella melitensis (B. melitensis) of Brucella abortus (B. abortus), waar ze endemisch zijn bij herkauwers (Olsen et al, 2012). Europa, inclusief Nederland, is al geruime tijd vrij van Brucellose bij varkens, hoewel er elk jaar enkele uitbraken in verschillende landen optreden (OIE, 2017). De ziekte bij varkens veroorzaakt verwerpen in zeugen en vruchtbaarheidsproblemen in zeugen en beren
Brucella suis is een meldingsplichtige ziekte volgens de uitvoeringsverordening (EU) 2018 /1882 van Animal Health Regulation (AHR) (EU) 2016 /429). Elke verdenking de ziekte dient te worden gemeld bij de NVWA. De NVWA heeft vanaf de melding de regie. Voor meer informatie over de regelgeving, beleids- en/of bestrijdingsdraaiboeken en melden kijk op nvwa.nl/onderwerpen/dierziekten/regelgeving-en-draaiboeken en nvwa.nl/onderwerpen/dierziekten/melden-dierziekte.
Veterinair kennisdossier Brucella suis
- Verschijnselen
- Diagnose
- Aanpak besmette bedrijven
- Preventie
- Websites/literatuur
- Bijlage/fotomateriaal
De kiem
Het genus Brucella is genetisch vrij homogeen, maar niet duidelijk verwant aan andere pathogenen. B. suis is een klein facultatief intracellulair, aëroob, gramnegatief staafje dat geen sporen vormt. De grootte varieert van 0,4-0,8 x 0,6-3,0 μm. B. suis is een -smooth'-vorm, zoals B. abortus en B. melitensis. Van B. suis worden vijf biovars onderscheiden, op basis van diverse specifieke tests. Echter, alleen biovars 1, 2 en 3 komen voor bij varkens brucellose. Biovars 1 en 3 zijn wereldwijd verspreid en ze zijn heel pathogeen voor mensen, maar biovar 2 is alleen in Europa gevonden en die komt daar ook het meest voor.
Gevoelige diersoorten
B. suis biovar 2 komt ook voor bij wilde zwijnen (Sus scrofa) en (Europese) hazen (Lepus europaeu), die dan ook een reservoir kunnen vormen (Garin-Bastuji et al., 2000; Abdoel et al., 2008; Cvetnic et al., 2009; Muñoz et al, 2010) en daarom een besmettingsrisico, speciaal in bedrijven met vrije uitloop (Godfroid and Käsbohrer, 2002; Godfroid et al., 2005; Cvetnic et al., 2009; EFSA, 2016). Er zijn geen data beschikbaar, maar in de literatuur staat dat het ziektebeeld bij biovar 1, 3 en 2 hetzelfde is bij varkens.
Volksgezondheid
B. suis biovar 1 en 3 zijn pathogeen voor de mens en een groot probleem voor de volksgezondheid waar B. suis endemisch is (Corbel, 2003). Echter, biovar 2 schijnt bijna niet pathogeen te zijn voor de mens. Brucellose is een beroepsziekte en jagers, slachthuismedewerkers, dierenartsen en boeren vormen de risicogroepen. Echter, er zijn maar enkele (Teyssou et al., 1989; Lagier, 2005; EFSA, 2016) casussen bij mensen zijn bekend en beiden waren immunogecompromitteerde patiënten.
Overleving
De tijd dat B. suis kan overleven buiten het varken varieert van enkele uren (bij zonlicht en hoge temperaturen) tot meer dan twee jaar (bij temperaturen rond of onder het vriespunt). Brucella overleeft pasteurisatie niet.
Desinfectie
Brucella is gevoelig voor de gangbare desinfectantia.
Verschijnselen van Brucella suis
De infectieroute bij varkens is genitaal (dekinfectie) of oraal. Dat laatste is waarschijnlijk de meest voorkomende route door opname van uitvloeiing of het opeten van besmette vruchtvliezen en/of verworpen vruchten. Na infectie passeert Brucella suis het slijmvlies en vervolgens komt het in de regionale lymfklieren, waarna gemiddeld twee (een tot zeven) weken na infectie een bacteriemie kan ontstaan. De bacteriaemie persisteert gemiddeld vijf weken, maar kan uitlopen tot bijna drie jaar.
Klinische verschijnselen
Klassieke symptomen zijn abortus, onvruchtbaarheid en orchitis. Motorische problemen, bijvoorbeeld ontsteking van de gewrichten, zijn ook mogelijk. Deze verschijnselen zijn niet pathognomonisch voor Brucellose. In veel koppels zijn de verschijnselen echter gering of onduidelijk. Verwerpen kan in elk stadium van de dracht optreden, ook al op zeventien dagen na genitale besmetting tijdens de dekking of inseminatie. Biggen kunnen ook congenitaal besmet worden geboren. De meeste zeugen herstellen goed na een genitale infectie. Bij beren is een genitale infectie persistenter dan bij zeugen. Pathologische veranderingen in de (bij-)geslachtsorganen zijn doorgaans irreversibel. Als de testikels zijn aangetast, zal de beer meestal onvruchtbaar worden. Klinische verschijnselen bij jonge varkens zijn verlammingen van de achterhand of gewrichtsontsteking.
Morbiditeit /mortaliteit
Hierover is geen data beschikbaar, maar als een naïef bedrijf door B. suis besmet wordt, treedt een heel grote uitbraak van verwerpen op. Er is dan veel contaminatie van het voer en de installaties en een paar maanden later is meer dan 50 procent van de dieren besmet (Olsen et al., 2012; Dieste-Pérez et al., 2016). Sterfte treedt zelden op.
Uitscheiding van de kiem
Bij aantasting van de bijgeslachtsklieren zal de beer vaak grote hoeveelheden brucellabacteriën uitscheiden in het sperma. Ook in verworpen vruchten en placenta’s worden grote hoeveelheden bacteriën uitgescheiden.
Differentiaaldiagnose
Klinische verschijnselen zijn niet specifiek voor Brucellose en de differentiaaldiagnose omvat ziekten als PRRS, Pseudorabiës-virus (Ziekte van Aujeszky), Porcine circovirus, Porcine parvovirus, Influenza en Leptospirose (Olsen et al., 2012). Bij orchitis kan eveneens gedacht worden aan Chlamydophilia spp. en wellicht ook aan andere bacteriële agentia. Virale aandoeningen die kunnen leiden tot orchitis zijn de exoten Bleu Eye paramyxovirus en het Japanese Encephalitis Virus.
Diagnose van Brucella suis
De verschillende testen zijn geschikt voor verschillende toepassingen. Zie tabel 1, overgenomen uit de OIE Terrestrial Manual, 2016.
Tabel 1: Beschikbare methodes voor de diagnostiek van Brucellose in varkens.
|
Test |
Bedoeling |
||||
|
Bedrijf vrij van infectie |
Dier vrij van infectie |
Voor eradicatie |
Confirmatie van het diagnostiek |
Bedrijfs prevalentie |
|
|
Agens identificatie |
|||||
|
Kweek |
- |
- |
- |
+++ |
- |
|
Kleuring |
- |
- |
- |
+ |
- |
|
Directe PCRd |
- |
- |
- |
+/++ |
- |
|
Immunologie |
|||||
|
BBAT |
+++ |
++ |
+++ |
+ |
+++ |
|
FPA |
++ |
++ |
+ |
++ |
++ |
|
CFT |
++ |
++ |
+++ |
++ |
+++ |
|
i-ELISA |
+++ |
++ |
+++ |
++ |
+++ |
|
c-ELISA |
++ |
+ |
+ |
+ |
++ |
|
BST |
++ |
- |
+ |
+++ |
++ |
|
SAT |
++ |
+ |
+ |
- |
+ |
|
NH en cytosol protein-based teste |
- |
- |
+ |
++ |
- |
Note: +++: sterk aanbevolen; ++: geschikt; +: mogelijk maar beperkt door kosten, tijd, moeilijkheid of anders; -: niet geschikt.
PCR = polymerase chain reaction; BBAT = buffered Brucella antigen tests (i.e. RBT [rose bengal test] and BPAT [buffered plate agglutination test]); FPA = fluorescence polarisation assay; CFT = complement fixation test; I- or C-ELISA = indirect/competitive enzyme-linked immunosorbent assay; BST = brucellin skin test; SAT = serum agglutination test; NH = native hapten
aThis applies only to herds/flocks, countries or zones free from infection with Brucella. bTo increase the efficiency of eradication policies in infected herds/flocks, it is recommended to associate tests in parallel so as to increase the sensitivity of the diagnosis, i.e. two serological tests at least, e.g. BBAT or FPA and CFT or I-ELISA. The sensitivity is further increased by parallel testing by both serology and BST. cIn low-prevalence or almost-free zones, the predictive value of positive results to serological tests may be very low. In such situations, agent identification is usually needed to confirm clinical cases. In infected herds/flocks, a positive result to any serological test may be considered as confirmation of a clinical case. In infected herds/flocks, a positive result to any serological test may be considered as confirmation of a clinical case. Any reactor in any serological test should be considered to be infected even in the absence of clinical signs. In low-prevalence or almost-free zones, single serological reactors may be confirmed by culture (or PCR) or BST. In free countries or zones, suspect animals are those positive to both a screening and a confirmatory serological test (tests in series) and may be confirmed by culture (or PCR) and/or BST. dFalse-positive results may occur. eIn zones where subcutaneous S19 or Rev.1 vaccination is practised, this test may help in differentiating antibodies due to vaccination from those due to infection.
Pathologie
B. suis kan in vele orgaansystemen worden aangetroffen als granulomatose-plekken. De keuze van de monsters is afhankelijk van de klinische verschijnselen, maar vaginale secreties, verworpen secreties, sperma of gewrichtsvloeistof zijn de voorkeursplaatsen (OIE, 2016). Van geëuthanaseerde dieren zijn de darmbeen lymfeknopen, milt en lies lymfeknopen de vaakst geïnfecteerde organen (Dieste-Pérez et al., 2014b; OIE, 2016). De meeste varkens herstellen na verloop van tijd (vier tot zes maanden), maar herstelde varkens blijken vaak persistent geïnfecteerd te zijn.
Isolatie van de kiem
Antigeen tests: Brucella suis is ‘risicovol’ in verband met het zoönotische karakter.
-
Een kweek uit de lymfeklieren is een erg gevoelige methode en belangrijk voor de bevestiging van de diagnose (OIE, 2016), maar selectieve media met antibiotica zijn nodig om de vervuiling te voorkomen (de Miguel et al., 2011; OIE, 2016) Daarna wordt identificatie van de species en biovar d.m.v. RFLP-PCR (Cloeckaert et al., 1995; Vizcaíno et al, 1997; Muñoz et al., 2010) of Multiplex PCR (García-Yoldi et al., 2006; López-Goñi et al., 2011; OIE, 2016) uitgevoerd.
-
Een directe PCR-test is een mogelijk methode (Hinic et al., 2009; Yu and Nielsen, 2010), maar de sensitiviteit is niet hoog, omdat er DNA inhibitoren aanwezig zijn in organen van dieren (Bouaadja et al., 2009; OIE, 2016).
-
De Immunohistochemische techniek kan gebruikt worden voor het aantonen van de bacterie in bijvoorbeeld testisweefsel (Mihaljevic et al. IPVS 2010).
-
Brucella suis-antigeen in weefsel is aantoonbaar met de FA (fluorescent antibody-techniek), maar dit is hooguit interessant in aangetaste placenta, niet in de lymfklieren.
Serologie
Antilichamen zijn aantoonbaar van zes tot acht weken na de infectie. Bij serologische testen bestaan problemen met de betrouwbaarheid door foutpositieve uitslagen als gevolg van kruisreacties, met in het bijzonder Yersinia enterocolitica O:9.Testen zijn vooral betrouwbaar voor bedrijfsscreening en prevalentie schatting, maar om de besmetting uit te sluiten zijn parallel uitgevoerde testen met hogere algemene sensitiviteit raadzaam. De meeste testen zijn modificaties van runderdiagnostiek en zijn niet gevalideerd voor varkens.
Kruisreacties in de serologische tests, die resulteren in foutpositieve uitslag, worden veroorzaakt door E. coli O:157, bepaalde Salmonella serovars (N-groep) en vooral door Yersinia entercolitica O:9. Het O-polysaccharide antigeen Yersinia is identiek aan het A-antigeen in het oppervlak van B. suis. Na infectie met Ye O:9 zijn in varkens gedurende twee tot negen weken foutpositieve uitslagen mogelijk (G. Jungersen et al., 2006). Na een infectie met B. suis is die periode beduidend langer.
Testen:
- Buis agglutinatietest (BUA)
- Complement Fixation Test (CFT)
- Rose Bengal Test (RBT)
-
De specificiteit bij deze drie testen ligt in orde van grootte van 98 procent, de sensitiviteit ligt beduidend lager.
- Competitieve Elisa: goede sensitiviteit en specificiteit.
In de ‘OIE Manual of Standards for Diagnostic Tests and Vaccins 2018’, chapter 3.1.4. en in de Europese Directive 90/429/EEC 1992 en 176/2012 en EFSA journal 2017, staat de Rose Bengal Test (RBT), iELISA, cELISA en FPA als voorgeschreven test voor de handel.
Vanaf 1 oktober 2000 is de RBT door de Europese Gemeenschap erkend voor het testen van varkenssera op de aanwezigheid van antistoffen tegen B. suis. Per 1 januari 2001 is de RBT in de Europese Gemeenschap de verplichte screeningstest voor het aantonen van antistoffen tegen B. suis in varkensserum.
Over het algemeen zijn serologische testen op de aanwezigheid van antistoffen tegen S-LPS voldoende gevoelig, maar specificiteit is afhankelijk van de aanwezigheid van kruisreactieve bacteriën (Dieste-Pérez et al., 2015a). Alle zijn voldoende voor Brucellose screening, maar meer specifieke testen zijn nodig voor bevestiging. iELISA en cELISA hebben goede diagnostische resultaten (EFSA, 2016), maar ze zijn niet gestandaardiseerd voor varkens en niet gevalideerd voor de nationale populatie. Daarom komen sensitiviteits- en specificiteitswaarden niet overeen.
De geschatte sensitiviteit en specificiteit van RBT, iELISA, cELISA en FPA worden weergegeven in Tabel 2, overgenomen uit de meta-analyse van EFSA journal 2009 en nieuwe literatuur (Muñoz et al., 2012; Dieste-Pérez et al., 2015a):
|
Test |
EFSA 2009 |
Muñoz et l., 2012 |
Dieste-Pérez et al, 2015a |
|||
|
Mean Se (CI) |
Mean Sp (CI) |
Mean Se (CI) |
Mean Sp (CI) |
Mean Se (CI) |
Mean Sp (CI) |
|
|
RBT |
0.74 (0.66 0.81) |
0.91 (0.86 0.94) |
1.00 (0.93–1.00) |
1.00 (0.95–1.00) |
0.93 (0.88–0.97) |
0.98 (0.97–0.99) |
|
iELISA |
1.00 (1.00-1.00) |
1.00 (1.00-1.00) |
1.00 (0.93-1.00) |
1.00 (0.95-1.00) |
0.95 (0.90–0.98) |
1.00 (0.99–1.00) |
|
cELISA |
1.00 (1.00-1.00) |
0.98 (0.98-0.98) |
0.68-093* (0.54-0.98) |
0.92-1.00* (0.84-1.00) |
NA |
NA |
|
FPA |
NA |
0.95 (0.94 0.96) |
NA |
NA |
NA |
NA |
Se, sensitiviteit; Sp, specificiteit; CI, confidence interval; NA, not available
*Afhankelijk van de commerciële test en cut-off gebruiken.
Note: de specificiteit was berekend in vrije populaties, waarbij Yersinia enterocolitica O:9 infecties niet zijn opgetreden, of zelfs in SPF populaties. Echter, in het artikel van Dieste-Pérez et al. (2015) werd de specificiteit van de RBT en iELISA berekend bij besmette populaties en de resultaten waren 0.57 (0.50-0.63) en 0.25 (0.19-0.31) respectievelijk.
Combinaties van parallel uitgevoerde testen zijn voldoende voor een hogere sensitiviteit (Table 1), maar combinaties van testen met hoge K-waarden (hoge diagnostieke overeenkomst) zijn niet van toegevoegde waarde. Testen gebaseerd op Pytosolic proteins zijn heel specifiek, omdat deze niet kruisreageren (alleen Ochrobactrum intermedium, maar het is geen relevant probleem in de varkensindustrie). De brucellin huid test is een goede confirmatie test, omdat deze heel sensitief en specifiek is, maar helaas is de validatie schaars en wordt het niet geaccepteerd als officiële test.
Een combinatie van een screening test en een confirmatie test is de routine controle in KI stations in Europa (Directive 176/2012), weergegeven in Figuur 1.
Figuur 1: schematisch toelatingsprotocol in KI stations met betrekking tot Brucella suis

In het najaar van 2004 heeft GD onderzoek gedaan naar de karakteristieken van een competitieve ELISA voor de detectie van antilichamen tegen B. suis. Deze ELISA is door de producent alleen gevalideerd voor runderen en schapen. In dit onderzoek is de cELISA vergeleken met de RBT.
Resultaten:
-
sensitiviteit: RBT voldeed aan de gestelde eisen, de cELISA scoorde minstens zo goed of zelfs iets beter
-
specificiteit: specificiteit van de RBT was 99,5 procent, van de cELISA 99,3 procent. Bij combinatiegebruik is de specificiteit 99,7 procent.
Gezien de problematiek van de foutpositieve uitslagen in de RBT wordt gezocht naar een test die een hogere specificiteit heeft dan de RBT. De cELISA voldoet hier niet aan in dit onderzoek.
In de OIE Manual of Diagnostic Tests and Vaccins for Terrestrial Animals, 5th edition, 2004 is een competitieve ELISA of een indirecte ELISA de voorgeschreven test voor de handel geworden, met de RBT als alternatieve test. In 2012 is de cELISA als test door de EG erkend voor gebruik in plaats van de RBT.
In 2008 is sprake geweest van KI-beren op een KI-station die foutpositief testten op Brucella suis. Positieve beren mogen niet ingezet worden als KI-beer, wat een flinke schadepost is. Bij de Coöperatieve KI is berekend dat 1,3 procent van de testuitslagen foutpositief is, terwijl uit een eerdere evaluatie van de test naar voren kwam dat dit slechts 0,3 procent zou zijn (2008).
De RBT die GD en het WBVR in Lelystad gebruiken is dezelfde en al sinds 2007 gebruikt men dezelfde batch. In de meeste gevallen worden positieve bevindingen ook door het WBVR bevestigd in andere testen. Aan de testeigenschappen is dus vermoedelijk niet veel veranderd. Wel is het protocol veranderd: één test positief betekent sinds 2008 dat melding plaatsvindt, terwijl voorheen pas na een eerste confirmatie melding werd gedaan.
De meest waarschijnlijke verklaring is in deze gevallen dat sprake is van kruisreacties met de bacterie Yersinia enterocolitica en/of sommige salmonella's of pasteurella's. Wellicht is de infectiedruk van die bacteriën hoger bij gebruik van stro van mindere kwaliteit. Hierin zitten veel muizen- en rattengangen. Ratten en muizen kunnen drager zijn van Yersinia.
In het najaar van 2010 was op een KI-station, waar geïmporteerde Deense Duroc-beren zijn gestationeerd, volgens de manager en de practicus sprake van opvallende zwelling van de testikels. Dit ging gepaard met de productie van matige tot slechte spermakwaliteit. Onderzoek op Brucella suis heeft niet aan het licht gebracht dat er sprake was van deze infectie.
Info van Topigs (september 2013):
cELISA als bindende confirmatie doet het goed. We hebben nog steeds 3,2 procent (fout)positieve RBT-uitslagen, maar meestal krijgen we binnen een paar dagen de negatieve confirmatie binnen en is het station weer vrij voor export.
Van een vergelijkend onderzoek naar serologische testen (McGiven et al., 2012) luidt de conclusie:
“An optimal serological testing strategy would have an sLPS based ELISA or TR-FRET assay as a screen with a confirmatory test based on the rLPS. Further validation studies on the rLPS iELISA are thus urgently required to promote its recognition and acceptance by the institutions, such as the OIE, that influence the means of control of porcine brucellosis.”
sLPS = smooth lipopolysaccharide;
rLPS = rough lipopolysaccharide
TR-FRET = time-resolved fluorescence resonance energy transfer
Prevalentie van Brucella suis
Nederland
In Nederland is Brucellose bij varkens voor het laatst vastgesteld in de jaren '60. In 1965 is de ziekte vastgesteld bij een beerhouderij in Holten. Toen zijn enkele contactbedrijven geruimd. In 1969 is een varkenshouder in Utrecht overleden aan de gevolgen van een Brucella suis-infectie, maar bij zijn zeugen werden geen verschijnselen waargenomen. De oorsprong van die infectie was swill-voedering van een poelier die Argentijnse hazen verwerkte. In 1969 zijn twee gerelateerde besmettingen vastgesteld in Limburg door clandestiene aankoop van Belgische dekberen.
Europa
Brucella (biovar 2) komt (waarschijnlijk) voor in de populatie wilde zwijnen op het Europese continent van Scandinavië tot de Balkan. Ook zou biovar 2 sporadisch voorkomen bij hazen in Europa. Genoemd worden infecties in Normandië en in Denemarken in relatie tot hazen. In Scandinavië en Centraal-Europa zou Brucella suis bij hazen endemisch voorkomen (The Pig Site, oktober 2007). Het (geringe) risico voor gedomesticeerde varkens bestaat vooral bij varkens die buiten lopen en contact met wilde zwijnen en/of met hazen kunnen hebben. Engeland en Ierland zouden vrij zijn van Brucella suis. De prevalentie in wilde zwijn is tussen 3.98 en 46 procent, afhankelijk van het land (Garin-Bastuji et al., 2000; Hubalek et al., 2002; Cvetnic et al., 2003; Al Dahouk e tl., 2005; Koppel et al, 2005; Bergagna et al., 2009; Muñoz et al., 2010). Tussen 2012 en 2014 werden 168 Nederlandse wilde zwijnen getest op Brucella en slechts twee dieren waren serologisch positief.
Op de website van de OIE zijn binnen Europa de volgende uitbraken gemeld van Brucellose bij varkens tussen januari 2015 en oktober 2017:
|
Land |
Jaar |
Casus |
Aantal dieren (wild zwijn/ varken) |
|
België |
2015 |
wild zwijn |
14/0 |
|
Bosnia en Herzegovina |
2015 en 2016 |
varken |
0/5 |
|
Kroatië |
2015 en 2016 |
varken |
0/2 |
|
Finland |
2015 en 2016 |
wild zwijn |
6/0 |
|
Duitsland |
2015 |
varken |
0/152 |
|
Hongarije |
2015 en 2016 |
wild zwijn en varkens |
14/13 |
|
Italia |
2015 en 2016 |
wild zwijn en varkens |
708/1 |
|
Romania |
2016 en 2017 |
wild zwijn |
13/0 |
|
Russia |
2015 |
varken |
0/14 |
|
Servië |
2015 en 2016 |
varken |
0/128 |
|
Spanje |
2015 en 2016 |
wild zwijn |
794/0 |
Brucellose lijkt zich vooral in Zuid Europa (Spanje en Italië) te manifesteren, zowel bij de wilde zwijnen als bij gehouden varkens.
Andere landen
Buiten Europa zijn sinds 1 januari 2007 bij het OIE meldingen geregistreerd van Brucellose bij varkens uit de Verenigde Staten, Argentinië, Armenië, Frans Polynesië, Kirgizië, Peru, Rwanda, Uruguay en de Wallis en Futuna-eilanden.
In 2011 en 2012 zijn enkele uitbraken gemeld in de Verenigde Staten en vele uitbraken in diverse Latijns-Amerikaanse landen. Van de meeste landen buiten Europa zijn geen gegevens over Brucella suis bekend.
Aangenomen mag worden dat de ziekte in veel landen voorkomt. In Zuidoost-Azië en Zuid-Amerika zou de prevalentie hoog zijn (Godfroid, 2002).
Aanpak van besmette bedrijven
Meldingsplichtig
Brucella suis is een meldingsplichtige ziekte volgens de uitvoeringsverordening (EU) 2018 /1882 van Animal Health Regulation (AHR) (EU) 2016 /429). Elke verdenking de ziekte dient te worden gemeld bij de NVWA. De NVWA heeft vanaf de melding de regie. Voor meer informatie over de regelgeving, beleids- en/of bestrijdingsdraaiboeken en melden kijk op nvwa.nl/onderwerpen/dierziekten/regelgeving-en-draaiboeken en nvwa.nl/onderwerpen/dierziekten/melden-dierziekte.
Algemeen maatregelen
Als een geval van infectie met Brucella spp. in varkens voorkomt in een vrij land, bevelen OIE en EU volledige depop-repop van het besmette bedrijf aan om verspreiding naar andere bedrijven te voorkomen. Geleidelijke eliminatie van geïnfecteerde dieren en vervanging door negatieve dieren is echter ook toegestaan (Dieste-Pérez et al., 2016; OIE, 2017; EFSA,2016).
Voor uitbraken van Brucellose bij varkens is geen draaiboek beschikbaar. In geval van een uitbraak ligt het voor de hand om het betreffende bedrijf af te sluiten en de varkens van het bedrijf te ruimen. Eenmaal geïnfecteerde dieren blijven lang 'uitscheider'. Varkens die in contact zijn geweest met een besmet varken blijven volgens het ‘Besluit verdachte dieren’ vier maanden verdacht.
Het bedrijf zal na ruiming goed ontsmet moeten worden, waarbij de gangbare ontsmettingsmiddelen voldoen. Dit het liefst in combinatie met een sanitaire leegstand van enkele weken. Brucella suis overleeft buiten het varken alleen lang onder winterse omstandigheden. Contactbedrijven zullen tijdelijk gesloten moeten worden en moeten worden onderzocht op een eventuele besmetting. Gezien het feit dat de verspreiding tussen varkens vooral via vrij intensief contact plaatsvindt, ligt het niet voor de hand om een beschermingsgebied rond een bedrijf in te stellen. Bedrijven op zeer korte afstand van een besmet bedrijf, kan men echter beschouwen als contactbedrijven.
Vaccinatie
Brucella suis biovar 2-vaccin is gebruikt voor het immuniseren van varkens in de Volksrepubliek China. Bevestiging van de verkregen resultaten in China is vereist voordat biovar 2-vaccin kan worden aanbevolen voor algemeen gebruik. In andere landen is bij experimenteel onderzoek gebleken dat B. mellitensis Ds 1-vaccin beter werkzaam is dan B. suis biovar 2. Van het Brucella abortus RB51-vaccin is ook aangetoond dat het doeltreffend is in varkens. In de praktijk is nog geen enkel vaccin algemeen aanvaard. De voorbereiding, het testen en het gebruik van een specifiek allergeen, brucellysaat (of brucelline fractie F) staan beschreven. (OIE manual of Standards for diagnostic tests & vaccines, 2000).
Antibiotica
Antibioticumtherapie is zeer beperkt effectief. Het risico bestaat dat dieren die zijn hersteld, drager blijven van de kiem. Echter, antibiotica kan in combinatie met test and removal gebruikt worden. Geen enkele monotherapie is voldoende effectief en een combinatie van twee soorten antibiotica is nodig. Oxytetracycline en tulatromycine zijn effectief om de bacteriële infectie te controleren en te verminderen tot niet-detecteerbare niveaus in experimentele onderzoeken bij herkauwers en varkens (Dieste-Pérez et al., 2014), maar ze zijn nog niet officieel geaccepteerd.
Persoonlijke beschermingsmiddelen
Aangezien Brucellose ook infectieus kan zijn voor mensen, met ziekteverschijnselen tot gevolg, dient men op een besmet bedrijf de nodige hygiënemaatregelen in acht te nemen en de volgende persoonlijke beschermingsmiddelen te gebruiken:
- Handschoenen
Wegwerphandschoenen: als handschoenen kapot gaan, handen reinigen en nieuwe handschoenen aantrekken.
Werkhandschoenen: bij grof werk werkhandschoenen over de wegwerphandschoenen dragen. - Wegwerpoverall
- Haarnetje
- Laarzen
- Gehoorbescherming
- Eventueel een masker en een veiligheidsbril
Werkinstructie
- Indien een persoonlijk beschermingsmiddel beschadigd raakt, onmiddellijk vervangen.
- Volgorde toepassen/aantrekken voor het betreden van het bedrijf: masker - bril - wegwerpoverall - haarnetje - laarzen - wegwerphandschoenen - werkhandschoenen.
- Volgorde uitdoen / afdoen na het betreden van het bedrijf: laarzen - werkhandschoenen - wegwerphandschoenen (dan handen ontsmetten met een huiddesinfectans) - wegwerpoverall (na openritsen overall opnieuw handen desinfecteren; overall alleen aan de schone binnenkant aanpakken en uittrekken) - haarnetje - bril - masker - opnieuw handen ontsmetten.
- Bij gebruik van bril en masker, deze als laatste afdoen om ogen en neus zolang mogelijk te beschermen voor indringen van stof, vooral ook tijdens het uittrekken van kleding. Houd bij het omkleden rekening met uw collega’s
Preventie van Brucella suis
Bedrijfshygiëne/insleeppreventie
Insleep wordt voorkomen door geen besmette dieren aan te voeren, in het bijzonder besmette dekberen. Voordat beren in een KI-station ingevoerd mogen worden, worden ze getest op onder andere Brucella suis in de RBT of de cELISA (ook op KVP en ZvA). Positieve dieren mogen niet naar de quarantaine die is voorgeschreven voordat beren het KI-station in mogen. Omdat het vaak om foutpositieve uitslagen gaat, werd steeds een tweede bloedmonster getest. Was die ook positief, dan werd de beer niet verhandeld als KI-beer en doorgaans geruimd.
Sinds enige tijd is het protocol aangescherpt: één test positief resulteert reeds in een melding, waarna direct een confirmatietest door het WBVR moet worden gedaan. Een logistiek gevolg hiervan is dat zeer geregeld een quarantainestal van een KI-station tijdelijk gesloten wordt.
Tijdens de voorgeschreven quarantaineperiode worden beren opnieuw getest op onder andere Brucella suis en worden positieve dieren eventueel een keer hertest. Als een beer dan opnieuw positief test, wordt deze geruimd. De overige beren in de quarantainestal worden dan opnieuw getest en de quarantaineperiode wordt verlengd.
Een positieve beer op een KI-station in de RBT wordt ter bevestiging in de SAT (Serum Agglutinatie Test) en CBR (Complement Binding Reactietest) getest. Positieve monsters gaan naar het WBVR te Lelystad. Bij bevestiging volgt bemonstering van andere dieren in dezelfde afdeling. Bij een wederom positieve bevinding wordt het KI-station gesloten. Positieve beren worden door de NVWA overgenomen en ter sectie bij het WBVR aangeboden. Indien dan alles negatief is, gaat het KI-station weer open. Zo niet dan zal zeer waarschijnlijk het station geruimd worden.
Vaccinatie
Tegen Brucella suis-infecties is geen vaccin beschikbaar.
Procedure bij verdenking
GD voert serologisch onderzoek uit op Brucella suis van (aspirant) KI-beren. In het geval van een positief monster, wordt de inzender op de hoogte gesteld en worden confirmatietesten uitgevoerd. Als een aspirant KI-beer positief is en blijft adviseert GD om de beer te ruimen. Als een KI-beer op een KI-station positief is en blijft wordt in overleg met de NVWA besloten tot nader onderzoek (sectie + bacteriologisch onderzoek en eventueel mestonderzoek). Het WBVR te Lelystad voert confirmatietesten uit indien dieren serologisch positief zijn voor Brucella suis. De NVWA kan besluiten een KI-station te sluiten indien een serieuze verdenking op besmetting bestaat.
Omdat bij verdenking een grote kans bestaat dat sprake is van een kruisreactie, ligt het voor de hand ook de bron daarvan te zoeken, dus: bacteriologisch onderzoek van mest- en stromonsters op Yersinia entercolitica O:9.
Bij verdenking op basis van een klinische bevinding zal een bedrijfsbezoek globaal verlopen zoals in het geval van een KVP-verdenking. Klinisch verdachte dieren kunnen het best direct ingezonden worden naar het laboratorium van het WBVR in Lelystad.
Websites en literatuur over Brucella suis
Websites
- OIE http://www.oie.int/
- FAO http://www.fao.org/
- EU http://www.ec.europa.eu/
- Center for Food Security and Public Health http://www.cfsph.iastate.edu/
Literatuur
- Abdoel TH, Dias IT, Cardoso R, Smits HL. 2008. Simple and rapid field tests for brucellosis in livestock. Vet Microbiol. 130:312-319.
- Al Dahouk S, Nockler K, Tomaso H, Splettstoesser WD, Jungersen G, Riber U, Petry T, Hoffmann D, Scholz HC, Hensel A, Neubauer H. 2005. Seroprevalence of brucellosis, tularemia, and yersiniosis in wild boars (Sus scrofa) from North-Eastern Germany. J Vet Med Ser B-Infect Dis Vet Public Health. 52:444-455.
- Bergagna S, Zoppi S, Ferroglio E, Gobetto M, Dondo A, Di Giannatale E, Gennero MS, Gratttarola C. 2009. Epidemiologic survey for Brucella suis biovar 2 in wild boar (Sus scrofa) population in Northwet Italy. J Wildl Dis. 45(4):1178-1181
- Cloeckaert A, Verger JM, Grayon M, Grepinet Ol. 1995. Restriction Site Polymorphism of the genes encoding the major 25 Kda and 36 Kda Outer-Membrane Proteins of Brucella. Microbiology +. 141(Part 9): 2111-2121
- Corbel MJ. 2006. Clinical manifestation (chapter 2) and epidemiology (chapter 3). In Brucellosis in humans and animals. Geneva, Switzerland: World Health Organization Press, pp. 3-12 and 13-21.
- Cvetnic Z, Mitak M, Ocepek M, Lojkic M, Terzic S, Jemersic L, Humski A, Habrun B, Sostaric B, Brstilo M, Krt B, Garin-Bastuji B. 2003. Wild boars (Sus scrofa) as reservoirs of Brucella suis biovar 2 in Croatia. Acta Vet Hung. 51:465-473
- Cvetnic Z, Spicic S, Toncic J, Majnaric D, Benic M, Albert D, Thiebaud M, Garin-Bastuji B. 2009. Brucella suis infection in domestic pigs and wild boar in Croatia. Rev Sci Tech Off Int Epizoot. 28:1057-1067.
- De Miguel MJ, Marín CM, Muñoz PM, Dieste L, Grilló MJ, Blasco JM. 2011. Development of a selective culture medium for primary isolation of the main Brucella species. J Clin Microbiol. 49:1458-1463
- Dieste-Pérez L, Blasco JM, De Miguel MJ, Marín CM, Barberán M, Conde-Álvarez R, Moriyón I, Muñoz PM, 2015. Performance of serological tests for swine brucellosis in presence of false positive serological reactions. J. Microbiol. Meth., 11, pp. 57-63
- Dieste-Pérez L, Fraile L, De Miguel MJ, Barberán M, Blasco JM, Muñoz PM. 2014. Studies on a suitable antibiotic therapy for treating swine brucellosis. Journal of Veterinary Pharmacology and Therapeutics.
- Dieste-Pérez L, Frankena K, Blasco JM, Muñoz PM, De Jong MCM, 2016. Efficacy of antibiotic treatment and test-based culling strategies for eradicating brucellosis in commercial swine herds Preventive Veterinary Medicine., 126, pp. 105-110
- EFSA, 2017. Assessment of listing and categorisation of animal diseases within the framework of the Animal Health Law (Regulation (EU) No 2016/429): infection with Brucella abortus, B. melitensis and B. suis). EFSA J. 15(7): 4889.
- García-Yoldi D, Marín CM, De Miguel MJ, Muñoz PM, Vizmanos JL, López-Goñi I. 2006. Multiplex PCR assay for the identification and differentiation of all Brucella species and the vaccine strains Brucella abortus S19 and RB51 and Brucella melitensis Rev1. Clin Chem. 52:779-781.
- Garin-Bastuji B, Hars J, Calvez D, Thiebaud M, Artois M. 2000. Brucellosis of domestic pigs. Re-emergence of Brucella suis biovar 2 in France. Epidemiol Santé Anim. 38 :1-5.
- Godfroid J, Cloeckaert A, Liautard JP, Kohler S, Fretin D, Walravens K, Garin-Bastuji B, Letesson JJ. 2005. From the discovery of the Malta fever´s agent to the discovery of a marine mammal reservoir, brucellosis has continuously been a re-emerging zoonosis. Vet Res. 36:313-326.
- Godfroid J, Kasbohrer A. 2002. Brucellosis in the European Union and Norway at the turn of the twenty-first century. Vet Microbiol. 90:135-145.
- Hubálek Z, Treml F, Juricova Z, Hunady M, Halouzka J, Janik V, Bill D. 2002. Serological survey of the wild boar (Sus scrofa) for tularaemia and brucellosis in South Moravia, Czech Republic.Veterinari Medicina. 47:60-66.
- Jungersen G, Sorensen V, Giese SB, Stack JA, Riber U. 2006. Differentiation between serological responses to Brucella suis and Yersinia enterocolitica serotype O:9 after natural or experimental infection in pigs. Epidemiol Infect. 134:347-357
- Köppel C, Knopf L, Ryser MP, Miserez R, Thür B, Stärk KDC. 2007. Serosurveillance for selected infectious disease agents in wild boars (Sus scrofa) and outdoor pigs in Switzerland. Eur J Wildl Res. 53:212-220.
- Lagier A, Brown S, Soualah A, Julier I, Tourrand B, Albert D, Reynes J, Garin-Bastuji B. 2005. Brucellose aiguë à Brucella suis biovar 2 chez un chasseur de sanglier. Med Mal Infect. 35:185.
- Mc Given JA, Nicola A, Commander NJ, Duncombe L, Taylor AV, Villari S, Dainty A, Thirlwall R, Bouzelmat N, Perrett LL, Brew SD, Stack JA. 2012. An evaluation of the capability of existing and novel serodiagnostic methods for porcine brucellosis to reduce false positive serological reactions. Vet Microbiol. 160:378-386.
- Muñoz PM, Blasco JM, Engel B, De Miguel MJ, Marín CM, Dieste L, Mainar-Jaime RC. 2012. Assessment of performance of selected serological tests for diagnosing brucellosis in pigs. Veterinary Immunology and Immunopathology. 146:150-158.
- Muñoz PM, Boadella M, Arnal M, De Miguel MJ, Revilla M, Martínez D, Vicente J, Acevedo P, Oleaga A, Ruiz-Fons F, Marín CM, Prieto JM, De la Fuente J, Barral M, Barberan M., De Luco DF, Blasco JM, Gortazar C. 2010. Spatial distribution and risk factors of Brucellosis in Iberian wild ungulates. BMC Infect Dis. 10.
- OIE, 2016. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Off Int Epizoot. Paris. Chapter 2.1.4.
- Olsen SC, Garin-Bastuji B, Blasco JM, Nicola AM, Samartino L. 2012. Brucellosis In: Zimmerman JJ, Karriker LA, Ramírez A, Schwartz KJ, Stevenson GW (Eds.) Diseases of Swine, 10th ed., Wiley-Blackwell, USA, pp. 697-708.
- Teyssou R, Morvan J, Leleu JP, Roumegou P, Goullin B, Carteron B. 1989. A propos d´un cas de brucellose humaine a Brucella suis biovar 2. Med Mal Infect. 12:160-161.
- Vizcaíno N, Verger JM, Grayon M, Zygmunt MS, Cloeckaert A. 1997. Dna polymorphism at the Omp-31 locus of Brucella spp - Evidence for a large deletion in Brucella abortus, and other species-specific markers. Microbiology. 143(Part 9): 2913-2921.
Bijlagen/fotomateriaal van Brucella suis
Illustratie uit Handboek varkensziekten (Van der Valk et al. 2003)