- BVD
BVD
Bovine Virus Diarree (BVD) is een wereldwijd veel voorkomende infectie onder rundvee en het BVD-virus kan op rundveebedrijven grote economische schade veroorzaken. De bestrijding van BVD is in 1998 van start gegaan met een vrijwillig programma BVD-vrij programma. Vanaf 1 april 2018 is de BVD-aanpak overgegaan naar een nieuwe, landelijke, fase.
Dierziekte informatie BVD
Het virus
Het virus dat bovine virus diarree veroorzaakt, behoort tot de familie Flaviviridae en het genus Pestivirus. Het Border Disease Virus (BDV) en het Klassieke Varkenspestvirus (CSF) behoren eveneens tot het genus der Pestivirussen. Op basis van genetische verschillen is het pestivirus genus in 4 verschillende groepen ingedeeld: BVDV, CSFV, BDV en een atypische groep.
Het BVD-virus (BVDV) wordt op basis van genetische verschillen en antigenetische eigenschappen opgesplitst in 2 typen: BVDV-1 en BVDV-2. Beide typen worden weer onderverdeeld in verschillende genetische subtypen, bijvoorbeeld BVDV-1b (zie figuur 2, Peterhans et al. 2010). In Nederland is BVDV-type 1 het meest voorkomende type. Het BVD-virus komt primair voor bij runderen, maar infecties in andere diersoorten, waaronder varkens en kleine herkauwers, komen ook voor.
Ongeacht het type BVDV (1 of 2) bestaan er 2 verschillende biotypes van BVDV. Op basis van het cytopathogene effect op celculturen wordt BVDV geclassificeerd als cytopathogeen (cp) of noncytopathogeen (ncp). Het cytopathogene biotype (cp) veroorzaakt vacuolisatie van het cytoplasma en degeneratie van cellen, in tegenstelling tot het non-cytopathogene biotype (ncp). De ncp-virussen zijn verantwoordelijk voor de transplacentaire infecties die resulteren in abortus, congenitale afwijkingen en de geboorte van persistent geïnfecteerde dieren (PI). Door genetische recombinatie kunnen cp-virussen ontstaan uit ncp-virussen. De combinatie van cp en ncp-virussen in PI dieren leidt tot mucosal disease (MD).
Transiënte infectie (TI)
Opname van BVDV (ncp biotype) geschiedt in het algemeen via oro-nasale opname. Na opname vermeerdert BVDV zich in de tonsillen, waarna BVDV zich verspreidt en lymfocyten en macrofagen binnendringt in de lokale lymfeknopen. BVDV heeft directe negatieve effecten op afweercellen en dit verklaart dat transiënt geïnfecteerde dieren in de acute fase een kortdurende leukopenie, lymfopenie en soms thrombocytopenie vertonen. Vervolgens kan 2 tot 4 dagen na infectie viremie optreden waarna verschillende organen en weefsels kunnen worden geïnfecteerd, afhankelijk van de virulentie van het BVDV-type. BVDV is dan aantoonbaar in bloed en dieren scheiden virus uit in alle se- en excreta.
Na infectie van immunocompetente dieren kunnen, afhankelijk van de virulentie van het BVDV-type, de verschijnselen variëren van mild tot ernstig met hoge mortaliteit. Bij een transiënte infectie is er altijd sprake van immunosuppressie door een combinatie van aantasting van de aangeboren immuunrespons en een lymfopenie. Dit leidt ertoe dat dieren vatbaarder worden voor secundaire infecties.
De duur van virusuitscheiding door transiënt geïnfecteerde dieren is afhankelijk van de virulentie van het BVDV-type en de efficiëntie van vermeerdering, maar varieert van zeven tot maximaal zeventien dagen. Na de systemische immuunrespons en verwijdering van BVDV uit het bloed is het mogelijk dat TI-dieren virus toch nog tijdelijk uitscheiden als gevolg van sequestratie van het virus. Op neusswabs kan tot 31 dagen na infectie BVDV worden aangetoond en in uitzonderlijke gevallen kan BVDV nog lang aangetoond worden in serum (80 dagen), oorbiopten (meer dan 80 dagen) en in sperma van TI-stieren (meer dan twee jaar).
Bij TI-dieren wordt de humorale immuunrespons gekarakteriseerd door de aanwezigheid van antilichamen vanaf twee tot drie weken na infectie. Na infectie blijven dieren levenslang seropositief, dat wil zeggen gedurende de levensduur van een commercieel gehouden rund.
Infectie tijdens de dracht
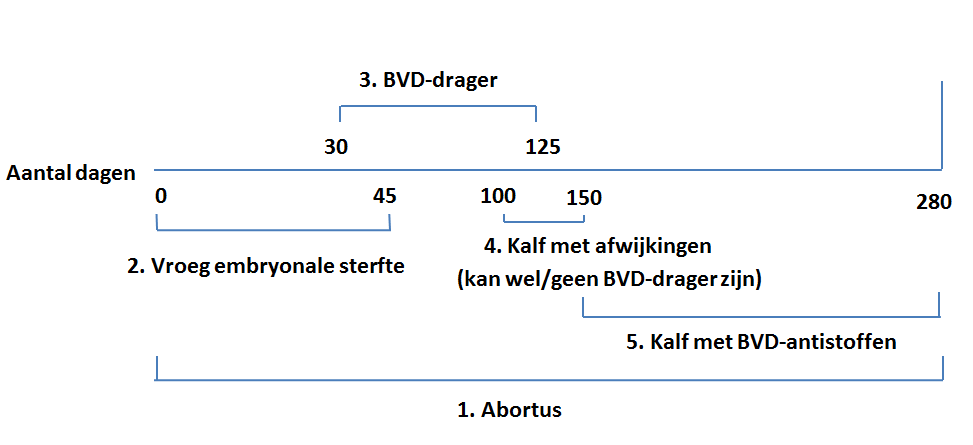
Vindt een BVD-infectie plaats bij een drachtig dier dat geen antistoffen tegen BVD heeft, dan kan dit leiden tot:
- Afsterven van de vrucht, gevolgd door mummificatie, resorptie of verwerpen. Dit kan gedurende de hele dracht optreden.
- Vroeg embryonale sterfte tot dag 45 na conceptie, dit wordt vaak niet opgemerkt.
- De geboorte van een persistent geïnfecteerd kalf (dragerkalf). Dit gebeurt als de vrucht tussen dag 30 en 125 van de dracht geïnfecteerd wordt. Omdat infectie plaatsvindt op het moment dat het immuunapparaat van het kalf nog niet is ontwikkeld, wordt het BVD-virus als lichaamseigen beschouwd. Het kalf zal dan ook geen antistoffen produceren.
- Geboorte van kalveren met waarneembare afwijkingen zoals oog-, vacht- en hersenafwijkingen. Deze dieren worden meestal besmet tussen dag 100 en 150 van de dracht. Beschreven zijn onder andere hypomyelinogenesis, hydrocephalus, cerebellaire hypoplasie, atrofie van de retina en microphtalmie. Deze afwijkingen komen zowel voor bij dragers als niet-dragers.
- Geboorte van kalveren met precolostrale antistoffen. Bij infectie tijdens de laatste drie maanden van de dracht is het afweerapparaat zodanig ontwikkeld, dat het kalf een BVD-infectie kan elimineren en antistoffen vormt. Abortus en geboorte van afwijkende of kleine zwakke kalveren is echter nog steeds mogelijk.
Persistente infectie (PI)
Tijdens een infectie met BVDV worden uterus, placenta en foetus makkelijk geïnfecteerd. Afhankelijk van het BVDV-biotype en de drachtlengte resulteert een BVDV-infectie van de foetus in vroeg embryonale sterfte, abortus, congenitale malformaties, geboorte van een PI-kalf of geboorte van een gezond kalf. Indien infectie van de foetus plaatsvindt tussen dag 30 en 125 van de dracht, dan worden virale eiwitten door de foetus gezien als lichaamseigen antigeen, aangezien de foetus nog niet immunocompetent is op dat moment. Dit resulteert in de geboorte van een persistent geïnfecteerd kalf. Deze PI-kalveren kunnen ogenschijnlijk gezond ter wereld komen, echter zullen levenslang BVDV uitscheiden. PI-kalveren zijn tolerant tegen het ‘eigen’ ncp BVDV-type, echter ze zijn immunocompetent tegen andere pathogenen. De immuunrespons is echter vaak minder effectief, waardoor de levensverwachting van PI’s vaak niet heel hoog is. In Nederland sterft meer dan 90 procent van de PI-kalveren voor de leeftijd van twee jaar.
Drachtige PI-moederdieren geven BVDV door aan nakomelingen, resulterend in de geboorte van nieuwe PI-kalveren. Het is daarom te adviseren om moederdieren van BVD-dragers te onderzoeken op BVD-virus. Sperma van PI-stieren bevat grote hoeveelheden BVDV, bevruchting met dit sperma kan resulteren in een acute infectie bij een seronegatief moederdier en eventueel uiteindelijk leiden tot de geboorte van een PI-kalf.
Bij PI-dieren kan mucosal disease optreden, indien een PI-dier geïnfecteerd wordt met cp BVDV. Mucosal disease is een ernstige vorm van BVD met hoge mortaliteit. Het cp-biotype kan ontstaan uit het ncp-biotype dat het PI-dier bij zich draagt door mutatie of recombinatie. Het is tevens mogelijk dat een PI-dier geïnfecteerd wordt met een homoloog cp BVDV, afkomstig van bijvoorbeeld een ander PI-dier dat aan Mucosal disease lijdt.
Epidemiologie
De transmissiesnelheid van infectieuze agentia binnen een koppel is afhankelijk van de reproductie ratio (R). De reproductie ratio wordt gedefinieerd als het aantal dieren dat kan worden geïnfecteerd door 1 infectieus dier in een gevoelige populatie. Als de R-waarde kleiner is dan 1, dan dooft de infectie uit, aangezien minder dan 1 ander dier wordt geïnfecteerd door een infectieus dier. Een aandoening kan zich dus verspreiden en eventueel leiden tot een (grote) uitbraak indien R>1, en zal uitdoven indien R<1. De reproductie ratio wordt bepaald door de volgende parameters: β = de kans op transmissie, к = frequentie van contact met naïeve dieren en D = de duur van de infectieuze periode (R=βкD). PI-dieren scheiden continue grote hoeveelheden BVDV uit en doen dit gedurende hun hele leven, resulterend in hoge waardes voor de parameters β en D. TI-dieren scheiden veel minder virus uit en doen dit tevens over een beperkte periode, resulterend in lage waardes voor de parameters β en D. PI dieren spelen daarmee een cruciale rol in de epidemiologie van BVD.
Na introductie van een PI dier in een gevoelige koppel zal BVDV zich binnen enkele weken tot maanden verspreiden totdat ongeveer 90 procent van de dieren een infectie heeft doorgemaakt en als gevolg daarvan antistoffen heeft gevormd. De snelheid van verspreiding binnen het bedrijf hangt sterk af van de parameter к.
Indien BVDV op een bedrijf wordt geïntroduceerd door introductie van een drager in een gevoelige koppel, dan ontstaat er in eerste instantie een primaire infectie. Afhankelijk van de virulentie van het BVDV zal dit gepaard gaan met meer of minder klinische verschijnselen. Indien een (groot) deel van de koppel drachtig zal zijn op het moment van BVDV-introductie, zal dit enkele weken later leiden tot een (beperkt) aantal abortussen en vijf tot acht maanden later mogelijk gevolgd door de geboorte van een of meer PI’s. Indien deze PI’s niet snel worden verwijderd uit de koppel wordt de virusverspreiding op het bedrijf in stand gehouden, waardoor problemen lang (tot twee jaar) kunnen aanhouden.
Verschijnselen van BVD
De klinische verschijnselen van BVD zijn afhankelijk van:
- Immuniteits- en vruchtbaarheidsstatus van het geïnfecteerde dier
- BVDV virulentie factoren
- Aanwezigheid secundaire/neveninfecties
Dit heeft toch gevolg dat de klinische verschijnselen kunnen variëren van matig tot ernstig met hoge mortaliteit en dit maakt het lastig om BVD te herkennen op basis van de klinische verschijnselen.
Acute infectie
Er wordt geschat dat ongeveer 70-90 procent van de acute infecties met BVD in immunocompetente, seronegatieve, dieren gepaard gaan met beperkte klinische verschijnselen. Daarom wordt een transiënte infectie bij volwassen dieren lang niet altijd opgemerkt. Een gedeelte van de acute BVD-infecties zal wel gepaard gaan met klinische verschijnselen in meer of mindere mate. De volgende klinische verschijnselen kunnen worden waargenomen:
- Productiedaling (tot 10 procent bij subklinisch geïnfecteerde koeien)
- Ontsteking van de slijmvliezen, waardoor slijmvlieserosies en –ulceraties
- BVDV kan enterocyten binnendringen waardoor diarree kan ontstaan
- Koorts
- Verminderde eetlust en/of uitdroging
- Abortus en fertiliteitsstoornissen
- Sterfte
In meer zeldzame gevallen kunnen transiënte BVD-infecties leiden tot (per)acute uitbraken gepaard gaande met koorts, pneumonie en haemorrhagisch syndroom (HD). Het haemorrhagisch syndroom wordt gekenmerkt door een ernstige trombocytopenie en bijbehorende verhoogde bloedingsneiging, waardoor zwarte of bloederige diarree en petechiën (mond- en tongslijmvlies) worden gezien. Dieren met dit beeld sterven veelal binnen 48 uur. De meeste HD-uitbraken worden veroorzaakt door BVDV-2. Acute uitbraken gepaard gaande met ernstige klinische verschijnselen zijn echter ook beschreven bij infecties met BVDV-1.
Immunosuppressie
Ondanks het feit dat BVD-infecties vaak een subklinisch verloop hebben, treedt bij alle transiënt geïnfecteerde dieren immunosuppressie op doordat BVDV-cellen het immuunsysteem infecteren en een negatief effect op deze cellen hebben. Dit leidt ertoe dat dieren makkelijker geïnfecteerd kunnen worden door secundaire pathogene kiemen. Co-infecties met secundaire pathogenen kunnen leiden tot economische schade door bijvoorbeeld Bovine Respiratory Disease en mastitis. In koppels koeien die in aanraking zijn geweest met BVDV kan meer mastitis worden waargenomen en kan het tankmelkcelgetal hoger zijn dan in naïeve koppels. BVDV speelt een belangrijke rol in het BRD-syndroom aangezien synergistische effecten zijn aangetoond voor co-infecties van BVDV met BRSV, IBR, PI-3, Mycoplasma bovis en Mannheimia haemolytica.
Kalveren
Door de immuniteitsverlagende eigenschappen van BVDV kunnen bij kalveren secundaire infecties eenvoudig toeslaan bij transiënt geïnfecteerde kalveren. Een BVD-infectie bij kalveren kan dan leiden tot diarree- en luchtwegproblemen. De mortaliteit bij kalveren (<1 jaar) is hoger in BVDV seropositieve koppels in vergelijking met seronegatieve koppels koeien.
Persistent geïnfecteerde dieren
Persistent geïnfecteerde kalveren kunnen behalve een verminderde immuunrespons en verlaagde levensverwachting ook klinisch afwijkend zijn bij de geboorte. Veel voorkomende afwijkingen die worden gezien zijn: neurologische problemen ten gevolge van hersenafwijkingen (trilkalveren, sterrenkijkers), oogafwijkingen (blindheid), dermatologische afwijkingen (te lang krullend haar) en groeivertraging.
Mucosal disease
Bij de acute vorm van MD sterven dieren binnen zeven tot veertien dagen, voorafgegaan door een ernstig ziektebeeld gepaard gaande met koorts, anorexie, kreupelheid, klauwlaesies, profuse waterige, soms bloederige, diarree en laesies van de mucosa van mondholte, slokdarm en het maagdarmkanaal. Deze laesies kunnen zich uitbreiden tot in de submucosa. Behandeling is niet mogelijk. In peracute gevallen sterven de dieren voordat klinische verschijnselen waarneembaar zijn. In uitzonderlijke gevallen wordt een drager geïnfecteerd met een CP-virus, dat qua antigene structuur afwijkt van het dragervirus. Dit leidt tot de chronische vorm van MD met intermitterende diarree. De dieren kwijnen binnen enkele weken tot achttien maanden weg.
Diagnose van BVD
Het stellen van de diagnose BVD op basis van klinische verschijnselen is niet betrouwbaar en zal moeten worden bevestigd met behulp van diagnostisch onderzoek. BVD-infecties kunnen op verschillende manieren worden aangetoond:
- Direct middels detectie van BVDV of virale componenten. Hiervoor heeft GD de volgende testen beschikbaar:
- BVD antigeen ELISA op serum (vanaf 31 dagen oud), oorbiopten of organen
- BVD virus PCR op tankmelk en serum
- BVD virus isolatie op serum en sperma
- BVD genotypering PCR op serum, tankmelk en weefsel
- Indirect middels detectie van de immuunrespons door middel van het aantonen van antistoffen. Hiervoor heeft GD de volgende testen beschikbaar:
- BVD antistoffen ELISA op serum en tankmelk
- BVD antistoffen ELISA titratie op serum
Detectie van BVD en virale componenten
Antigen Enzyme Linked ImmunoSorbent Assays (Ag-ELISA)
Met de Ag-ELISA kan BVD-antigeen worden aangetoond in serum, organen of in oorbiopten. De Ag-ELISA die door GD wordt gebruikt is gericht op het envelop glycoprotein Erns-eiwit. De test toont zowel de BVDV type 1 als type 2 aan. Doordat dit eiwit in relatief grote hoeveelheden uitgescheiden wordt door geïnfecteerde cellen en daarbij relatief geconserveerd is, kan het goed aangetoond worden in serum en oorbiopten. De sensitiviteit van de test is 99-100 procent. De specificiteit is 99,5 procent. De Ag-ELISA is betrouwbaar en relatief goedkoop, echter vals-negatieve resultaten in serum kunnen optreden door aanwezigheid van maternale antistoffen. Maternale antistoffen kunnen het antigeen wegvangen, waardoor het niet beschikbaar is voor de test. Serum van dieren jonger dan 31 dagen is daarom niet geschikt voor onderzoek middels de Ag-ELISA.
De Ag-ELISA kan ook worden toegepast op oorbiopten. Aangezien er geen contact met bloed plaats vindt bij het nemen van het oorbiopt, heeft de aanwezigheid van maternale antistoffen geen invloed op de uitslag van deze test. De oorbiopten kunnen daarom op zeer jonge leeftijd (direct na geboorte) worden genomen en onderzocht. Voor het nemen van een oorbiopt zijn speciale oormerken nodig. Oormerkleveranciers hebben deze bioptoormerken in hun assortiment. Meer over BVD Oorbiopten.
Reverse-Transcription Polymerase Chain Reaction (RT-PCR)
Met de PCR-test wordt BVDV-RNA (type 1 en 2) aangetoond in tankmelk of serum. Door de hoge sensitiviteit (100 procent) van deze test kan BVDV-RNA gedetecteerd worden in materiaal met lage hoeveelheden BVDV-RNA. De RT-PCR is daarom geschikt voor onderzoek van tankmelkmonsters (tot maximaal 300 melkgevende dieren). Wanneer meer dan 300 melkgevende dieren via tankmelk moeten worden onderzocht geldt een afwijkend protocol. De RT-PCR is ongevoelig voor maternale antistoffen en daardoor is de test ook geschikt voor (bloed)onderzoek van kalveren jonger dan een maand (mits niet gepoold). Voor oudere dieren kan serum getest worden in pools van 15 monsters. De specificiteit van de test in serum is 99 100 procent. In tankmelk is de relatieve specificiteit voor het aantonen van PI dieren 96-100 procent. Dit wordt veroorzaakt doordat een enkele keer de tankmelk PCR positief reageert door het optreden van acute infecties in de koppel voordat er PI dieren geboren zijn.
Virusisolatie
Middels virusisolatie kan levend BVDV worden gedetecteerd door celculturen te inoculeren met monstermateriaal en vervolgens drie tot vijf dagen later te onderwerpen aan immunofluorescentie of immunoperoxidase kleuring. Op deze manier kan virusisolatie worden toegepast voor het aantonen van BVDV in bloed(serum) en sperma. Bij sectiemateriaal wordt deze test soms gebruikt om de diagnose mucosal disease te stellen (waarbij cytopathogeen BVDV wordt aangetoond).
BVD genotypering PCR
Met behulp van een real-time PCR kan onderscheid worden gemaakt tussen BVD-genotype 1 en 2. De PCR kan worden ingezet als vervolgonderzoek voor het genotyperen van individuele BVD-positieve monsters (serum, tankmelk en weefsel).
Detectie van BVD-antistoffen
Antistoffen-ELISA (Ab-ELISA)
Met de Ab-ELISA worden antistoffen tegen BVD aangetoond in serum of tankmelk. Het is tevens mogelijk (gepaard) bloedonderzoek uit te voeren middels ELISA-titratie. Een titer ≥2 betekent dat BVD-antistoffen zijn aangetoond. De ELISA-screening geeft het wel of niet aanwezig zijn van antistoffen aan. De sensitiviteit en specificiteit van de test op individueel serum is respectievelijk 98 en 99,2 procent. Bij het tankmelkonderzoek ligt het omslagpunt van de uitslag ‘tankmelk angetoond’ naar ‘niet aangetoond’ bij ongeveer 30 procent besmette melkgevende runderen.
Vaccinatie in relatie tot BVD-diagnostiek
Bij GD wordt voor de Ab-ELISA gebruik gemaakt van een NS3-blocking ELISA, gericht op het NS3-eiwit (ook wel p80 genoemd). NS3 is een niet-structureel eiwit, het maakt geen deel uit van de mantel van het virus, maar is verantwoordelijk voor het opdelen van het virale polyproteine in verschillende delen en is noodzakelijk voor het ontstaan van infectieuze viruspartikels. Het NS3-eiwit is dan ook essentieel voor de replicatie van het virus en komt alleen tot expressie tijdens vermenigvuldiging van BVDV in de gastheercel. Dit betekent dat er na een veldinfectie, en vaccinatie met een levend vaccin, antistoffen tegen NS3 worden aangetoond. Na vaccinatie met een inactief vaccin worden antistoffen niet of nauwelijks aangetoond, omdat de geïnactiveerde virusdeeltjes uit de vaccins zich niet vermenigvuldigen. Hoe vaker een dier gevaccineerd is met geïnactiveerd vaccin, hoe meer kans op (kortdurende) antistoffenreactie in de ELSA.
Bij gebruik van een levend vaccin dient hier rekening mee gehouden te worden bij virusdiagnostiek. Na vaccinatie met een levend vaccin kan tot 23 dagen BVDV in bloed, melk en in oorbiopten van kalveren geboren uit gevaccineerde moeders worden aangetoond.
Aandachtspunten bij BVD-onderzoek
- Pas geboren kalf: oorbioptonderzoek middels Ag-ELISA. Het oorbiopt wordt afgenomen bij het aanbrengen van het oormerk.
- Bloedonderzoek bij dieren jonger dan 31 dagen: individueel PCR. In verband met de mogelijke interferentie van maternale antistoffen die van invloed kan zijn op de uitslag, is de Ag-ELISA niet geschikt bij dieren jonger dan 1 maand.
- Bloedonderzoek bij dieren ouder dan 31 dagen: bloedonderzoek PCR of antigeen-ELISA. Uit kostenoverweging wordt meestal gekozen voor de Ag-ELISA
- Een transiënte infectie bij (volwassen) runderen kan worden aangetoond door uitvoering van gepaard serologisch onderzoek, middels ELISA-titratie, met tenminste drie weken tussentijd.
- Mogelijke BVDV-dragers kunnen worden opgespoord middels Ag-ELISA. Om te bepalen of een dier een persistent of transiënt geïnfecteerd dier is, is heronderzoek op BVDV noodzakelijk (> drie weken tussentijd). Afhankelijk van de uitslag van het heronderzoek zijn er twee opties mogelijk:
- Bij heronderzoek wederom virus aangetoond: het betreffende rund is een BVD-drager.
- Bij heronderzoek geen virus aangetoond: het betreffende rund heeft een BVD-infectie doorgemaakt. Het dier is dus onlangs in aanraking geweest met het BVD-virus, maar heeft de BVD-infectie overwonnen en antistoffen gemaakt. Hierbij valt op dat de detectie van antistoffen soms langer duurt dan drie weken.
Abortusdiagnostiek
Bij abortus kan de diagnose worden gesteld door middel van virologisch en serologisch onderzoek van de vrucht en/of van het moederdier.
De uitslag van het serologisch bloedonderzoek van het moederdier wordt als volgt beoordeeld:
- Geen antistoffen aangetoond: dit sluit BVD als oorzaak van het verwerpen uit. Een moederdier zonder BVD-antistoffen in het bloed kan wel BVD-virusdrager zijn. In geval van abortus is dat echter meer uitzondering dan regel.
- Antistoffen aangetoond: in de loop van de tijd is het aantal dieren dat antistoffen heeft steeds lager geworden (mits niet gevaccineerd). Het aantonen van antistoffen betekent in elk geval dat het dier is blootgesteld geweest aan BVDV. Gepaard serologisch onderzoek van het moederdier is weinig zinvol aangezien de infectie in de meeste gevallen al een tijd geleden heeft plaatsgevonden en de dieren al antistoffen hebben op het moment van verwerpen.
Beoordeling van het virologisch onderzoek van de verworpen vrucht is als volgt:
- Indien BVDV aangetoond middels Ag-ELISA, wordt ter confirmatie PCR-onderzoek verricht. Indien in beide testen BVDV wordt aangetoond duidt dit op een intra-uteriene infectie.
- Geen BVDV aangetoond, dit kan betekenen dat:
- BVD geen rol speelt.
- De vrucht de infectie overwonnen en het virus geëlimineerd heeft.
- Het BVDV niet aangetoond kan worden door de staat van de vrucht.
Prevalentie
Nederland
BVD-programma’s
Vanaf 1998 zijn er BVD bestrijdingsprogramma’s geweest. Eerst waren die vrijwillig maar sinds april 2018 zijn rundveehouderijen die melk leveren aan een Nederlandse zuivelonderneming aangesloten bij de Nederlandse Zuivel Organisatie (NZO), verplicht om deel te nemen aan een BVD programma om BVD-vrij te worden. In 2012 was het percentage vrije of onverdachte bedrijven 30 procent. In de daaropvolgende jaren is het percentage vrije en onverdachte bedrijven gestegen naar 47 procent in augustus 2016 (2013: 31 procent, 2014: 36 procent, 2015: 38 procent). In het tweede kwartaal van 2023 nam 98,8% van alle melkveebedrijven deel aan de bestrijding van BVD en van deze bedrijven had 90% de gunstige status BVD-vrij of BVD-onverdacht. Van de niet-melkleverende bedrijven nam 23% deel aan de bestrijding. Van deze bedrijven had 85,1% een gunstige status.
In 2019 was de geschatte landelijke prevalentie voor zoogkoeien 7,5 procent (95 procent betrouwbaarheidsinterval: 4,3-11,9) en voor kleinveebedrijven 12,0 procent (95 procent betrouwbaarheidsinterval: 6,1-20,4).
Buitenland
Omdat BVD-infecties grote economische verliezen veroorzaken, zijn verschillende Europese landen gestart met verplichte bestrijdings- en certificeringsprogramma's.
De Scandinavische landen zijn al vrij lang bezig met de eradicatie van BVDV. Finland, Noorwegen, Zweden en Denemarken zijn in 1993-1994 begonnen met BVD bestrijdingsprogramma’s en deze landen zijn inmiddels BVD-vrij. In deze landen was vaccinatie geen onderdeel van het programma en is het gelukt BVD-vrij te worden zonder het gebruik van vaccins. In Oostenrijk is in 1997 gestart met een vrijwillig programma en in 2004 is gestart met de landelijke aanpak, vergelijkbaar met de Zweedse aanpak.
Sinds de introductie van het BVDV-onderzoek op oorbiopten zijn meer landen gestart met BVDV controleprogramma’s, zoals bijvoorbeeld in Zwitserland. In Duitsland is in 2011 een landelijk bestrijdingsprogramma van start gegaan, waarbij is gekozen voor een scenario met het elimineren van dragers in combinatie met vaccinatie. In Frankrijk wordt naast het opsporen van dragers, vaccinatie geadviseerd. In België is in 2015 een verplicht landelijk BVD-bestrijdingsprogramma gelanceerd.
BVD is een categorie C+D+E ziekte volgens de Animal Health Law van de Europese Unie (EU). Dat betekent dat landen zelf bepalen of ze de ziekte willen uitroeien (C), maar moeten wel BVD indammen via internationale handelaren, vervoerders of reizigers (D) en de ziekte moet in de gaten gehouden worden en elk kwartaal gemeld worden (E).
Lidstaten en zones van de EU met de ziektevrije status (laatste update 27 oktober 2021): Oostenrijk, Denemarken, Finland, Zweden en delen van Duitsland. Lidstaten en zones van de EU met een goedgekeurd uitroeiingsprogramma: Ierland en delen van Duitsland.
Aanpak van BVD
Nederland - bestrijdingsprogramma
Elk melkleverend bedrijf dat aangesloten is bij NZO, moet deelnemen aan het programma om BVD-vrij te worden. Het programma is van ZuivelNL en wordt uitgevoerd door GD. Er zijn vier routes die gevolgd kunnen worden: Route Intake virus, bewaking jongvee antistoffen, Route Tankmelk, Route Jongvee antistoffen, Route Oorbiopten. Voor het schematische overzicht zie BVD aanpak routes.
In het kort:
- Route Intake virus, bewaking jongvee antistoffen: eenmalig worden alle dieren onderzocht op virus (melkgevende dieren kunnen onderzocht worden met tankmelkonderzoek op virus) en 10 maanden lang worden alle nieuw geboren kalveren onderzocht op virus met oorbiopten. Alle gevonden dragers worden afgevoerd. Na afvoer van een drager gaat de periode van 10 maanden opnieuw in. Na het afronden intakefase krijgt het bedrijf de vrijstatus en start de bewaking van halfjaarlijks een steekproef van jongvee tussen de 8 en 12 maanden oud.
- Route Tankmelk: tankmelkonderzoek van bedrijven zonder BVD antistoffen, 4 keer per jaar. Na één gunstig tankmelkonderzoek wordt de BVD-onverdachtstatus toegekend. Na minimaal 24 maanden een gunstig tankmelkonderzoek, krijgt het bedrijf de BVD-vrijstatus.
- Route Jongvee antistoffen: bedrijven doen halfjaarlijks een steekproef onder het jongvee waarbij vijf dieren tussen de 8 en 12 maanden onderzocht worden op BVD antistoffen. Na één gunstige steekproef krijgt het bedrijf de BVD-onverdachtstatus. Na minimaal 24 maanden een gunstig resultaat bij de jongvee steekproef, krijgt het bedrijf de BVD-vrijstatus.
- Route Oorbiopten: 10 maanden lang worden alle nieuw geboren kalveren onderzocht op BVDV middels oorbiopten. Alle gevonden dragers worden afgevoerd. Na afvoer van een drager gaat de periode van 10 maanden opnieuw in. Na 10 maanden krijg het bedrijf de BVD-onverdachtstatus. Het nemen van oorbiopten gaat door als bewaking. Na in totaal minimaal 34 maanden van gunstige virusuitslagen, krijgt het bedrijf de vrijstatus.
- Essentieel onderdeel van de bewaking is het onderzoek na aanvoer van dieren van niet-vrije bedrijven.
Voor de actuele, geldende protocollen wordt verwezen naar https://www.zuivelnl.org/programmas/ibr-en-bvd/bestrijding-ibr-bvd-protocollen.
Ook niet-melkleverende bedrijven kunnen vrijwillig meedoen aan het programma.
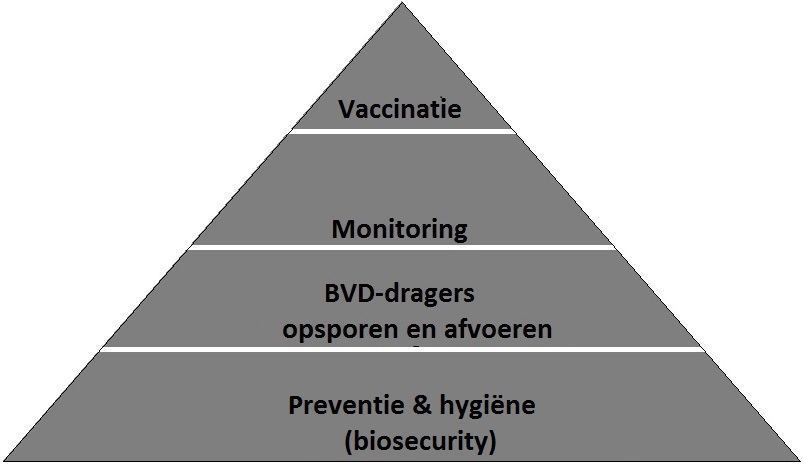
Algemene principes
- Biosecurity en preventie
- Opsporen en afvoeren PI dieren
- Monitoring
Als 4e element kan vaccinatie daaraan worden toegevoegd, indien aan de eerste 3 pijlers is voldaan. Hieronder zijn de 4 pijlers schematisch weergegeven.
Biosecurity en preventie
Biosecurity omvat alle procedures en (preventieve) maatregelen die worden genomen om een koppel te beschermen tegen infectieuze aandoeningen, in dit geval BVDV. Hiervoor is het belangrijk om de risicofactoren met betrekking tot insleep en verspreiding van BVD-infecties op een bedrijf in kaart te brengen. Een hulpmiddel hierbij is de GD Checklist BVD-preventie.
Werkwijze bedrijfsspecifieke risicofactoren
Met de Checklist BVD-preventie kan worden nagegaan in hoeverre een bedrijf kans loopt op insleep en verspreiding van BVD op het bedrijf. Door invulling van de checklist krijgt men een risicoprofiel voor BVD op het bedrijf, met adviezen om de kans op insleep en verspreiding verder te verkleinen.
Insleep
De risicofactoren voor insleep geven aan waar zich een risico bevindt voor het binnenhalen van de BVD-infectie op het bedrijf. De risicofactoren voor insleep kunnen weer verder worden onderverdeeld in directe en indirecte contacten. De risicofactoren met betrekking tot directe contacten:
- Aanvoer van dieren van bedrijven met een lagere BVD-status.
- Aankoop van dieren die drachtig zijn van een PI-dier (Trojaans rund).
- Gezamenlijke jongvee-opfok of uitschaareenheid.
- Over-de-draadcontacten met (niet vrije) buurtbedrijven.
- Bezoek aan (niet-vrije) keuringen en shows.
- Erfbetreders (zonder bedrijfskleding).
- Het gebruik van gezamenlijke veetransportmiddelen en materialen met andere (niet-vrije) bedrijven.
- Het inslepen van BVDV met medicijnflesjes, naalden, spuiten, handschoenen, kleding, laarzen etc.
- Het gebruik van besmet sperma en besmette embryo’s.
- Niet-gecertificeerde buurtbedrijven.
Versleep
De factoren met betrekking tot versleep zijn zowel op BVD-vrije als niet-vrije bedrijven van belang. Het is immers niet uitgesloten dat op een BVD-vrij bedrijf toch weer BVD-virus wordt geïntroduceerd.
De risicofactoren met betrekking tot versleep zijn ook weer onder te verdelen in direct en indirect contact. De risicofactoren met betrekking tot direct contact:
- Afkalfmanagement
- Gescheiden afkalfhokken
- Contact kalveren onderling
- Contact tussen kalveren en drachtig (jong)vee
- Huisvesting (leeftijdsgroepen, zieke dieren apart)
- All-in, all-out
- Looplijnen (van jong naar oud)
- Hygiëne van handen en kleding bij contact verschillende leeftijdsgroepen
- Huisvesting (reinigen en desinfectie van hokken na verplaatsen dieren):
- Bij de geboorte van een PI-dier worden met het vruchtwater grote hoeveelheden BVDV uitgescheiden, waardoor besmetting van het afkalfhok kan optreden.
- Hokken en stallen waar PI dieren zijn gehuisvest kunnen voor een bepaalde periode een bron van BVDV zijn.
Opsporen en afvoeren PI-dieren
Een tweede belangrijke maatregel in het BVD plan van aanpak is het opsporen van eventuele PI-dieren op het bedrijf. PI-dieren scheiden continue grote hoeveelheden BVDV uit en doen dit gedurende hun hele leven. Transiënt geïnfecteerde dieren scheiden veel minder virus uit en doen dit tevens over een beperkte periode. PI-dieren spelen daarmee een cruciale rol in de epidemiologie van BVD. Voor een succesvolle BVD-bestrijding moeten deze dieren worden opgespoord en afgevoerd.
Monitoring
Monitoring is een derde belangrijke pijler voor een succesvolle BVD-aanpak en controle. Monitoring is van belang om te bepalen of het BVD-virus effectief is geëlimineerd op besmette bedrijven. Tevens is monitoring belangrijk voor de detectie van introductie van BVDV op (vrije) bedrijven.
Dus bewaking van de BVD situatie is van belang op bedrijven met een vrijstatus en op bedrijven waar geen aanwijzingen voor BVDV circulatie zijn. Afhankelijk van de gekozen route wordt er bewaakt via virusonderzoek (route oorbiopten) of antistoffenonderzoek (middels jongveesteekproef of tankmelk).
Vaccinatie
Naast de bovenstaande genoemde pijlers biosecurity, opsporen en afvoeren van PI-dieren en monitoring, kan vaccinatie als vierde element worden ingezet bij een effectieve BVD-bestrijding en controle. Uit de laatste prevalentie uit 2015, blijkt dat de landelijke prevalente van melkveebedrijven met een indicatie voor BVD-viruscirculatie 8,7 procent bedraagt. De prevalentie in de niet melkleverende sector in zijn geheel bedraagt 14,5 procent. Gezien de besmettingsgraad van BVD in Nederland kan geen garantie worden gegeven tegen (her)introductie van BVD-virus op (vrije) bedrijven. Vooral op bedrijven met een reëel of groot besmettingsrisico (zie Checklist BVD-preventie) kan bedrijfsvaccinatie de gevolgen van insleep beperken.
In Nederland zijn verschillende BVD-vaccins op de markt. Vaccins op basis van geïnactiveerd virus en op basis van levend virus. Een DIVA-vaccin is in Nederland (nog) niet beschikbaar. Vaccins hebben mede tot doel om transplacentaire infectie te voorkomen.
Een bescherming van 100 procent door BVDV-vaccinatie is onrealistisch, bijvoorbeeld door antigenetische variatie van het BVD-virus en het voorkomen van inadequate immuunresponsen in individuele dieren. Daarnaast kunnen er ook ongevaccineerde dieren zijn door bijvoorbeeld aanvoer of door bij de vaccinatie gemiste dieren.
Daarom zijn voor een efficiënte BVD-bestrijding altijd biosecuritymaatregelen (ter preventie van de introductie van het virus) monitoring, en als basis het opsporen en afvoeren van PI-dieren noodzakelijk.