Contagious caprine pleuropneumonia (CCPP)
Contagious caprine pleuropneumonia (CCPP) is een ziekte die bij geiten in Afrika en Azië voorkomt. De aandoening wordt veroorzaakt door de bacterie Mycoplasma capricolum subspecies capripneumoniae. De kiem zorgt voor een ernstige serofibrineuze pleuropneumonie waarbij de morbiditeit kan oplopen tot 100 procent en de mortaliteit tot 80 procent.
CCPP valt onder categorie A-, D- en E-ziekte als bepaald in Uitvoeringsverordening (EU) 2018 /1882 van Animal Health Law (AHL) (EU) 2016 /429. Elke verdenking van de ziekte dient direct te worden gemeld bij de NVWA.
Veterinair kennisdossier Contagious caprine pleuropneumonia (CCPP)
- Verschijnselen
- Diagnose
- Prevalentie
- Aanpak besmette bedrijven
- Preventie
- Websites en literatuur
- Klinische beelden
De kiem
Contagious caprine pleuropneumonia wordt veroorzaakt door de bacterie Mycoplasma capricolum subspecies capripneumoniae, eerder ook bekend als Mycoplasma biotype F38. In Algerije werd de aandoening in 1873 voor het eerst beschreven als ‘bou frida’, wat duidt op de aantasting van één longhelft. In 1976 werd pas duidelijk welke kiem de oorzaak was van de aandoening. Intussen is de aanwezigheid van de aandoening in de continenten Afrika, Azië en Zuidoost Europa beschreven. Met de hoogste prevalentie in Saudi-Arabië en Kenya.
De bacterie is afkomstig uit de klasse Mollicutes, behorende tot de Mycoplasma mycoides-cluster waar meerdere species en subspecies onder vallen. Mycoplasma mycoides subsp. mycoides (kleine en grote kolonievorm), de Mycoplasma sp. bovine groep 7 van Leach, de Mycoplasma capricolum subsp. capricolum en de Mycoplasma mycoides subsp. capri vallen onder deze cluster. De Mycoplasma mycoides subsp mycoides (kleine kolonievorm) is verantwoordelijk voor de contagious bovine pleuropneumonia in runderen, waarmee ook geiten en schapen geïnfecteerd kunnen worden. Een infectie met deze kiem leidt bij de kleine herkauwers zelden tot kliniek. Mycoplasma mycoides subsp capri (grote kolonievorm) is in staat om mastitis, arthritis, keratitis, pneumonie en septicaemie bij de geit veroorzaken.
Gevoelige diersoorten
Het werd lange tijd verondersteld dat Mycoplasma capricolum subsp capripneumoniae diersoortspecifiek zou zijn en enkel geiten infecteert. De geit wordt beschouwd als de natuurlijke gastheer van CCPP. Hoewel schapen ook geïnfecteerd kunnen worden, is het tot op heden niet bekend of dit leidt tot een persistente infectie. Toch dient er rekening te worden gehouden met een mogelijke reservoirfunctie.
Andere leden van de bovidae familie worden tegenwoordig eveneens gezien als gevoelige diersoorten. Hieronder vallen de wilde herkauwerachtige, zoals Nubische steenbok, mouflon, girafgazelle en gazelle, die met hoge percentages morbiditeit en mortaliteit te maken kunnen hebben. Zowel deze (niet-) gedomesticeerde evenhoevigen net als schapen kunnen worden besmet door geiten. De rol van de wilde herkauwers is onduidelijk; deze groep zou zowel reservoir als dead end host kunnen zijn. Er moet in ieder geval rekening gehouden worden met potentiele overdracht van CCPP tussen de gevoelige diersoorten.
Volksgezondheid
Er zijn geen meldingen van met CCPP geïnfecteerde mensen. CCPP wordt niet beschouwd als een zoönose.
Overleving
Mycoplasma bacteriën kunnen doorgaans kort buiten de gastheer overleven. Gemiddeld overleeft de bacterie tot drie dagen in warme gebieden en tot twee weken in gematigde klimaten. UV-straling kan de bacterie binnen enkele minuten inactiveren.
Desinfectie
De bacterie is gevoelig voor allerlei ontsmettingsmiddelen, zeep en hitte.
Verschijnselen van CCPP
Infecties met CCPP kunnen peracuut, acuut en chronisch verlopen. Typische uitbraken met CCPP wordt in een naïeve populatie gekenmerkt door hoge morbiditeit en mortaliteit.
Klinisch beeld
De gemiddelde incubatietijd bij een infectie onder natuurlijke omstandigheden wordt geschat tussen 6 tot 10 dagen, maar kan soms ook pas 3 tot 4 weken na infectie optreden. De aandoening kenmerkt zich door aantasting van enkel het respiratie apparaat.
Peracute vorm
‘Plotseling dood’ is kenmerkend in de peracute vorm. Er worden voorafgaand aan de sterfte weinig/geen verschijnselen waargenomen en sterfte treedt op binnen 1 tot 3 dagen.
Acute vorm
De acute vorm start met zeer hoge koorts, zwakte en anorexie. Na 2 tot 3 dagen begint het dier te hoesten en is er sprake van dyspneu. In het laatste stadium is het dier niet meer in staat te staan, houdt het de voorpoten wijd uit elkaar, heeft het een stijve en gestrekte hals. Het dier speekselt continu, heeft neusuitvloeiing en kan verschijnselen van pijn vertonen. Sterfte volgt met 7 tot 10 dagen.
- Hoge koorts (41-43 ⁰C)
- Anorexie
- Zwakte
- Sufheid
- Vermagering
- Dyspneu
- Versnelde ademhaling
- Hoesten
- Neusuitvloeiing
- Speekselen
- Niet in staat op te staan
- Abortus
- Sterfte <10 dagen
Chronische vorm
Deze vorm kenmerkt zich door chronische hoesten, neusuitvloeiing en zwakte.
- Hoesten
- Neusuitvloeiing
- Zwakte
Morbiditeit/mortaliteit
In de literatuur worden zeer hoge morbiditeit- en mortaliteitspercentages beschreven. Een morbiditeit van 100 procent wordt beschreven en het mortaliteitspercentage loopt op tot 80 procent in naïeve koppels.
De morbiditeit verschilt amper tussen vatbare diersoorten. De mortaliteit is daarentegen wel verschillend tussen diersoorten. De mortaliteit onder geiten ligt significant hoger dan bij schapen.
Uitscheiding van de kiem
De bacterie wordt vanuit de luchtwegen uitgescheiden en verspreidt zich via aerosolen tussen dieren. Doorgaans komen de aerosolen vrij tijdens het hoesten en vindt infectie over korte afstanden plaats. Omstandigheden waarbij dieren nauw in contact staan zijn ideaal voor de verspreiding (figuur 1). Desondanks wordt in de literatuur gesuggereerd dat aerosolen tot wel 50 meter verspreiden en infectie veroorzaken. De exacte infectieuze periode van een geïnfecteerd dier is niet bekend. In computermodellen (in silico) wordt een infectieuze periode van 19 dagen berekend.
Het ontstaan van dragers is wetenschappelijk niet bewezen, maar wordt wel waarschijnlijk geacht. Hierdoor kan introductie van één of meerdere ogenschijnlijk gezonde dieren in een gevoelige koppel tot een uitbraak leiden.
Verspreiding van de aandoening via indirect contact, via materialen en dergelijke, zou een ondergeschikte rol spelen in de verspreiding. Dit heeft met de eigenschappen van de bacterie te maken, waardoor deze minder gemakkelijk overleeft in de omgeving. Risicofactoren in endemisch landen op koppelniveau zijn contact met andere koppels, aanwezigheid van een handelsroute en de aanwezigheid van schapen. Dit geeft aan dat diercontacten een risicoverhogende rol spelen in de verspreiding van CCPP.
Experimenteel is intranasale, intratracheale, endobronchiale infectie en bij direct contact met een besmet dier bewerkstelligd.
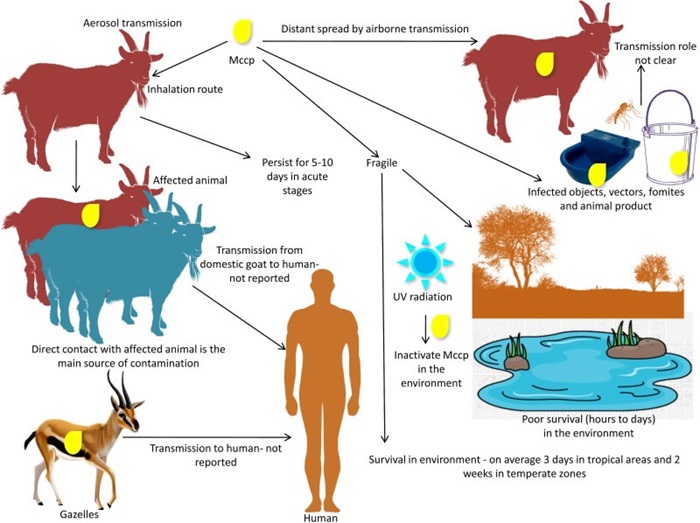
1 Transmissie van Mycoplasma capricolum subsp. capripneumoniae (Yatoo et al., 2019)
Differentieel diagnostiek
Voor de differentiaaldiagnose in peracute vorm, waarbij plotselinge sterfte optreedt:
- Trauma
- Anthrax
- Enterotoxemie
- Encefalitis/-pathie
- Meningitis
- Cerebrocorticale necrose
- Pseudorabiës (Ziekte van Aujeszky)
- Vergiftiging (planten, chemisch)
- Pneumonie
- Pens acidose
- Septikemie
- Listeriose
- Hypocalcemie
Voor de differentiaaldiagnose komen in aanmerking in acute en chronische vorm:
- Contagious agalactie syndroom (andere mycoplasma bacteriën):
- Mastitis
- Arthritis
- Keratitis
- Pneumonie
- Sepsis
- Pasteurellose
- Peste des petits ruminants
Diagnose van CCPP
Pathologie
De voornaamste bevinding bij acute CCPP is het samenvallen van de longen, veelal unilateraal. Dit is in vrijwel alle gevallen zichtbaar. Daarnaast wordt er veel vocht gevonden in alveolair weefsel en in de pleurale holte. In de pleurale holtes vormen zich al spoedig fibrine draden (pleuritis). Het vocht in de pleurale holte is ‘stro-achtig’ van kleur.
Chronische infecties kenmerken zich door een chronische pleuropneumonie of chronische pleuritis, waarbij ingekapselde ontstekingshaarden en fibrinedraden binnen de thorax gevonden worden.
Isolatie van de kiem
De hoogste aantallen bacteriën zijn terug te vinden in de vloeistof in de pleurale holte. Ook aangetast longweefsel op de overgang van geconsolideerd naar niet-geconsolideerd weefsel is doorgaans een geschikte locatie voor monstername voor bacteriologisch onderzoek (BO). Ander weefselmateriaal dat kan worden bemonsterd is exsudaat van de longen en regionale lymfeknopen. Monsters moeten gekoeld bewaard/getransporteerd worden en binnen 48 uur worden ingezet. Is dit niet mogelijk dan wordt aangeraden materiaal in te vriezen. Let op: voor BO-mycoplasma zijn specifieke kweekmedia nodig.
Naast bacteriologisch onderzoek, wat de gouden standaard is, is het mogelijk een PCR toe te passen. De PCR is vooral geschikt indien er weinig Mycoplasma sp. aanwezig is in weefsel. Ook is PCR-confirmatie volgend op bacteriologisch onderzoek mogelijk. Het heeft dan ook de voorkeur om kweek van Mycoplasma capricolum subspecies capripneumoniae (Mccp) te bevestigen met PCR. Daarnaast is immuunhistochemie een indirecte methode om antigeen in weefsels aan te tonen.
Monsters genomen bij vermoeden van infectie met Mycoplasma capricolum subspecies capripneumoniae (Mccp) worden door WBVR in behandeling genomen.
Serologie
Er bestaan vele Mycoplasma subspecies. Dit leidt bij mycoplasmaserologie tot kruisreacties, vooral onder de M. mycoides-clusters. Tevens is de specificiteit laag. Bovendien worden (per)acute gevallen gemist doordat sterfte optreedt voordat er (voldoende hoge) antilichamen in het bloed aantoonbaar zijn. Individuele gevallen bevestigen met serologie wordt dan ook afgeraden.
Ontwikkelde serologische testen voor CCPP:
- Complement fixatie test
- Indirecte hemagglutinatie test
- Competitieve ELISA
Prevalentie van CCPP
Nederland
In Nederland is CCPP tot op heden niet aangetoond.
Europa
De aandoening speelt momenteel niet in Europa. In 2006 is CCPP aangetoond in Griekenland en in 2009 werd de aandoening in Servië aangetoond. Er is een prevalentie studie in Zuidoost-Europa uitgevoerd in Turkije. Uit deze studie is gebleken dat de geschatte prevalentie onder geiten in Turkije rond de 8 procent (95 procent CI; 6.91–9.09 procent) zou liggen.
Andere landen
CCPP komt nog steeds voor in delen van Afrika en Azië (figuur 2). Uit prevalentie-studies op deze continenten blijkt dat er in enkele landen CCPP aanwezig is of is geweest. Deze prevalenties zijn bepaald op basis van zowel antistoffen als het aantonen van de bacterie. Daarbij is er geen verschil in het voorkomen op basis van leeftijd, geslacht en type kleine herkauwer gevonden. De prevalentie van CCPP onder geiten varieert van 3,70 tot 51,65 procent. De gemiddelde prevalentie onder schapen komt neer op 23,19 procent (95 procent CI: 11.90–34.47 procent) en 24,91 procent (95 procent CI: 20.99–28.84 procent) onder geiten.
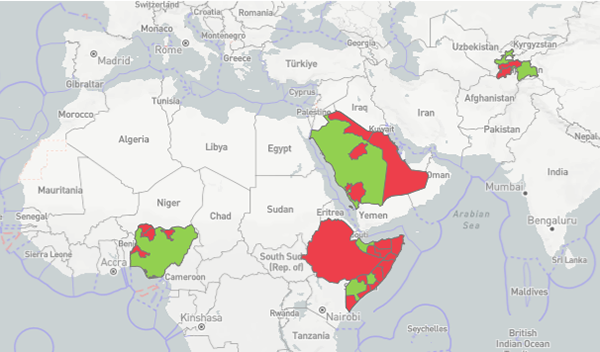
Figuur 2 Figuur 2 WAHIS-OIE overzicht aanwezigheid van CCPP in 2023. In Nigeria, Ethiopië, Saudië-Arabië, Somalië en Tajikistan is aanwezigheid van CCPP (rode gebieden) aangetoond. ProMed heeft gemeld dat de Nebbi regio in Uganda sinds 2022 worstelt met het onder controle krijgen van CCPP. Meldingen door houders wordt niet consequent gedaan noch geadviseerde maatregelen opgevolgd. Na de eerste helft van 2022 zijn geen meldingen opgenomen in WAHIS van CCPP in Uganda.
Daarbij is er geen verschil in het voorkomen op basis van leeftijd, geslacht en type kleine herkauwer gevonden. De prevalentie van CCPP onder geiten varieert van 3,70 tot 51,65 procent. De gemiddelde prevalentie onder schapen komt neer op 23,19 procent (95 procent CI: 11.90–34.47 procent) en 24,91 procent (95 procent CI: 20.99–28.84 procent) onder geiten.
CCPP lijkt aanwezig te zijn op enkele continenten in een beperkt aantal landen. Echter, dit kan een onderschatting van de werkelijkheid zijn. Het aantonen van de bacterie is lastig en de geschikte diagnostiek is niet altijd en overal voorhanden. Monitoring op het voorkomen wordt slechts beperkt uitgevoerd. Tevens kan CCPP verward worden met andere aandoeningen, waardoor een foutieve (waarschijnlijkheids)diagnose gemakkelijk op basis van de verschijnselen en de hoge mortaliteit gesteld kan worden.
CCPP - regelgeving
Nederlands recht
In ‘Regeling houders van dieren’ in artikel 3b.3 wordt aangegeven dat er geen ‘niet levende entstof’ of ‘serum’ gebruikt mag worden bij CCPP bij geiten. Met andere woorden: vaccinatie tegen CCPP is niet toegestaan.
Europees recht
In de Uitvoeringsverordening (EU) 2018/1882 is aangegeven dat besmettelijke pleuropneumonie bij geiten onder codes A+D+E vallen. Onder codering A wordt verondersteld dat deze aandoening niet in Europa voorkomt en bestreden dient te worden indien de aandoening wordt aangetoond. Tevens gelden er aparte regels rondom import en export (code D) en wordt geacht dat de aandoening wordt gemonitord (code E).
Internationaal
Zoals in Europees recht is aangegeven bestaat er regelgeving rondom import en export van geiten voor wat betreft CCPP. Landen binnen de EU dienen te voldoen aan de Europese regels voor vervoer van en naar de EU en daarbinnen.
In Verordening (EU) 2016/429 is opgenomen dat verspreiding van dierziekten binnen de EU te beperken door directe melding aan Commissie en andere lidstaten en voorzorgsmaatregelen te nemen. Meer informatie over regelgeving omtrent import en export kunt u bij de NVWA opvragen.
Aanpak besmette bedrijven
Meldingsplicht
CCPP is een aangifteplichtige ziekte volgens de Verordening (EU) 2018/1882. Een aangetoonde infectie of een vermoeden van dient direct te worden gemeld bij de NVWA. Deze meldplicht geldt voor zowel de houder als de dierenarts.
Vaccinatie
Er zijn in Europa geen vaccins beschikbaar ter preventie van CCPP. Wel zijn er vaccins ontwikkeld op basis van geïnactiveerde Mycoplasma capricolum subspecies capripneumoniae (Mccp) die een bescherming van één jaar garanderen. ‘Regeling houder van dieren artikel 3b.3’ geeft aan dat vaccineren tegen CCPP in Nederland niet is toegestaan.
Antibiotica
Mycoplasma bacteriën zijn in de regel ongevoelig voor bèta lactam-antibiotica door het ontbreken van een celwand. Mycoplasma capricolum subspecies capripneumoniae (Mccp) is in eerdere onderzoeken gevoelig gebleken tegen ciprofloxacine, tetracycline en tylosine. Behandeling leidt niet per se tot genezing, waardoor in potentie dragerschap geïnduceerd kan worden.
Overige maatregelen
Een vervoersverbod (en/of andere maatregelen waarbij zicht is op het transport / de verplaatsingen van dieren) is het meest efficiënt om verdere verspreiding te voorkomen.
Preventie van CCPP
Het grootste gevaar van CCPP-insleep is import van dieren die besmet zijn. Het is tot dusver onduidelijk maar wel waarschijnlijk geacht dat er dragers kunnen ontstaan. Tevens bij besmetting en overleven van CCPP is het ook onduidelijk hoe lang dieren zullen uitscheiden.
Bij aankoop:
- Quarantaine van aangekochte dieren
- Testen aangekochte koppel
In de literatuur wordt vaccinatie als mogelijkheid genoemd. Vaccins zijn lastig beschikbaar, maar zijn in het verleden effectief geweest bij uitbraken in endemische gebieden. Zowel morbiditeit als het voorkomen van mortaliteit. In Nederland is het volgens ‘Regeling houder van dieren artikel 3b.3’ niet toegestaan om te vaccineren tegen CCPP.
Websites en literatuur
Literatuur
- Ahmad, F., et al., The first isolation and molecular characterization of Mycoplasma capricolum subsp. capripneumoniae Pakistan strain: A causative agent of contagious caprine pleuropneumonia. J Microbiol Immunol Infect, 2021. 54(4): p. 710-717.
- Yatoo, M.I., et al., Comparative evaluation of different therapeutic protocols for contagious caprine pleuropneumonia in Himalayan Pashmina goats. Trop Anim Health Prod, 2019. 51(8): p. 2127-2137.
- Thomas, P., Rapport medical sur le Bou Frida. . 1873, Jourdan A. Alger: Publ. Gouverneur General Civil L’Algerie. p. 35.
- MacOwan, K.J. and J.E. Minette, A mycoplasma from acute contagious caprine pleuropneumonia in Kenya. Trop Anim Health Prod, 1976. 8(2): p. 91-5.
- Iqbal Yatoo, M., et al., Contagious caprine pleuropneumonia - a comprehensive review. The veterinary quarterly, 2019. 39(1): p. 1-25
- Hernandez, L., et al., Mycoplasma mycoides subsp. capri associated with goat respiratory disease and high flock mortality. Can Vet J, 2006. 47(4): p. 366-9.
- Bolske, G., et al., Contagious caprine pleuropneumonia in Uganda and isolation of Mycoplasma capricolum subspecies capripneumoniae from goats and sheep. Vet Rec, 1995. 137(23): p. 594.
- Litamoi, J., Wanyangu, S., Simam, P. , Isolation ofMycoplasma biotype F38 from sheep in Kenya. . Tropical Animal Health and Production, 2005. 22: p. 260-262.
- Arif, A., et al., Contagious caprine pleuropneumonia outbreak in captive wild ungulates at Al Wabra Wildlife Preservation, State of Qatar. J Zoo Wildl Med, 2007. 38(1): p. 93-6.
- EFSA Panel on Animal Health and Welfare (AHAW), S.M., Anette Bøtner, Andrew Butterworth, Paolo Calistri, Klaus Depner,Sandra Edwards, Bruno Garin-Bastuji, Margaret Good, Christian Gortazar Schmidt,Virginie Michel, Miguel Angel Miranda, Søren Saxmose Nielsen, Mohan Raj, Liisa Sihvonen,Hans Spoolder, Jan Arend Stegeman, Hans-Hermann Thulke, Antonio Velarde,Preben Willeberg, Christoph Winckler, Francesca Baldinelli, Alessandro Broglia,Denise Candiani, Beatriz Beltran-Beck, Lisa Kohnle and Dominique Bicout, Assessment of listing and categorisation of animal diseaseswithin the framework of the Animal Health Law (Regulation(EU) No 2016/429): contagious caprine pleuropneumonia. EFSA journal, 2017: p. 27.CONTAGIOUS CAPRINE PLEUROPNEUMONIA [cited 2022 21-02-2022]; Available from: https://www.oie.int/fileadmin/Home/eng/Animal_Health_in_the_World/docs/pdf/Disease_cards/CONTAGIOUS_CAPRINE_PLEURO.pdf.
- Quinn P.J., M.B.K., Carter M.E., Donnelly W.J., Leonard F.C. , Veterinary Microbiology and Microbial Disease. . 2 ed. 2008: Wiley-Blackwell 928.
- Shiferaw, G., et al., Contagious caprine pleuropneumonia and Mannheimia haemolytica-associated acute respiratory disease of goats and sheep in Afar Region, Ethiopia. Rev Sci Tech, 2006. 25(3): p. 1153-63.
- Lignereux, L., et al., Unexpected field observations and transmission dynamics of contagious caprine pleuropneumonia in a sand gazelle herd. Prev Vet Med, 2018. 157: p. 70-77.
- Abbass, S., A study on contagious caprine pleuropneumonia in four selected states in the Sudan. , in Faculty of Veterinary Science. 2006, University of Khartoum: Khartoum, Sudan. p. 88.
- Hussain, R., et al., Caprine pleuropneumonia in Beetal goats [corrected]. Trop Anim Health Prod, 2012. 44(3): p. 477-81.
- Nicholas, R. and C. Churchward, Contagious caprine pleuropneumonia: new aspects of an old disease. Transbound Emerg Dis, 2012. 59(3): p. 189-96.
- Awan, M.A., Abbas,F., Yasinzai, M., Nicholas, R.A.J., Babar, S., Ayling, R.D., M. Attique, A., and Ahmed, Z., Prevalence of mycoplasma capricolum subspecies capricolum and mycoplasma putrefaciens in goats in pishin district of balochistan. Pakistan Veterinary Journal, 2009. 29(4): p. 179-185
- OIE WAHIS. [cited 2023 104-1-2023]; Available from: https://wahis.oie.int/#/dashboards/country-or-disease-dashboard.
- Ozdemir, U., et al., Survey of contagious caprine pleuropneumonia in goat herds in the Thrace region of Turkey. Rev Sci Tech, 2018. 37(3): p. 831-836.
- Ahaduzzaman, M., Contagious caprine pleuropneumonia (CCPP): A systematic review and meta-analysis of the prevalence in sheep and goats. Transbound Emerg Dis, 2021. 68(3): p. 1332-1344.
- Molla W, Zegeye A, Mekonnen SA, Fentie T, Berju A, Nigatu S, Kenubih A, Haile B, Jemberu WT.Risk factors associated with contagious caprine pleuropneumonia in goats of Amhara region, Ethiopia. Prev Vet Med. 2023 Mar 28;215:105909
- UITVOERINGSVERORDENING (EU) 2018/1882 VAN DE COMMISSIE. 2018: 3 december 2018. VERORDENING (EU) 2016/429 VAN HET EUROPEES PARLEMENT EN DE RAAD. 2016: 6 maart 2016. https://eur-lex.europa.eu/legal-content/NL/TXT/PDF/?uri=CELEX:32016R0429&from=EN
- Diergeneesmiddelenbank. [cited 2022 11-1-2022]; Available from: https://www.diergeneesmiddeleninformatiebank.nl/ords/f?p=111:1:0:::RP,1:P0_DOMAIN,P0_LANG:V,NL.Regeling houders van dieren. 2021: 1-11-2021.
Bijlage foto's klinische beelden
Hieronder enkele voorbeelden van klinische en pathologische beeldvorming van de aandoening.
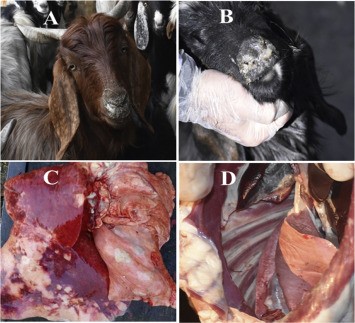
Figuur 3 (A en B), Geit vertoond pijnlijke hoest en ernstige mucopurulente neusuitvloeiing; (C en D), postmortem met typische CCPP unilaterale rode hepatisatie en fibrineuze pleuropneumonie. (Ahmad et al., 2021)
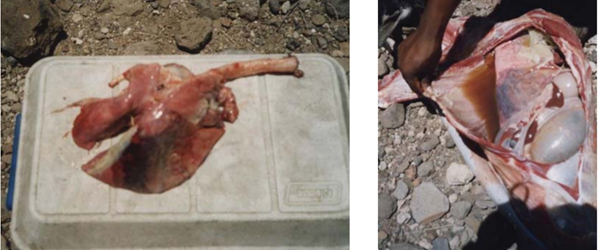
Figuur 4 Links toont een eenzijdige afwijkende long. Rechts is een typische stro-achtige kleur van het exsudaat in de borstholte zichtbaar en fibrine. (Shiferaw et al., 2006)