Definitie
Scrapie is een besmettelijke, zeer langzaam verlopende aandoening van het zenuwstelsel bij schapen en geiten. Na een lange incubatietijd en een slepend verloop eindigt de ziekte met de dood. Een behandeling is niet mogelijk.
In het Verenigd Koninkrijk is de ziekte ruim 250 jaar geleden beschreven. In Nederland is scrapie bij schapen in oktober 1957 voor het eerst vastgesteld. Het is echter aannemelijk dat de ziekte ook in Nederland al veel langer voorkomt. Bij de geit werd in november 2000 het eerste geval gediagnosticeerd, gevolgd door een tweede geval enkele maanden later. De elf resterende geiten op dit bedrijf werden geruimd en bij vier van de elf dieren werd ook scrapie aangetoond. Sindsdien is onderzoek bij de geit in ons land altijd negatief verlopen. Dit betekent dat het laatste geval van scrapie bij geiten in Nederland in 2001 is vastgesteld. Scrapie is een meldingsplichtige ziekte volgens artikel 15 van de Gezondheids- en Welzijnswet voor Dieren. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA.
Oorzakelijk agens
Scrapie behoort tot de TSE’s (transmissible spongiform encephalopathies). Het histopathologisch beeld van de hersenen kenmerkt zich bij dieren met een TSE door sponsachtige structuurveranderingen. De verwekker van scrapie wordt aangeduid met de naam ‘prion’ (proteinaceous infectious particle). De gevoeligheid voor scrapie is erfelijk bepaald en dit wordt, voor zover bekend, door één enkel gen, het PrP-gen, gecontroleerd. Dit PrP-gen bepaalt de aanmaak en eigenschappen van het normaal voorkomend prioneiwit (PrP = prion protein = prioneiwit). Dit normale prioneiwit wordt aangegeven met PrPC (c staat daarin voor cellulair). Bij dieren met een prionziekte als bijvoorbeeld scrapie komt een veranderde vorm van het PrP voor; deze veranderde vorm wordt aangegeven met PrPSc (scrapie protein; is identiek met scrapieverwekker). Als schapen in contact komen met het PrPSc kunnen ze, afhankelijk van hun gevoeligheid voor de ziekte, scrapie ontwikkelen. Het diereigen PrPC wordt na besmetting omgezet in PrPSc en dit gebeurt sneller en efficiënter bij dieren met een gevoelig genotype. Vier varianten van het PrP-gen zijn van belang: VRQ, ARQ, AHQ en ARR. Een schaap met genotype VRQ/VRQ is het gevoeligst voor scrapie en een schaap met het genotype ARR/ARR is het ongevoeligst.
Over de genetische ongevoeligheid van geiten is minder bekend en in de tweede helft van 2012 is een internationaal onderzoek gestart onder leiding van Wageningen Bioveterinary Research (WBVR) in Lelystad. Hieraan heeft ook GD deelgenomen. Mede gestimuleerd door problemen in een aantal andere EU-lidstaten is duidelijk geworden dat geiten die 222K drager zijn, met andere woorden geiten die op codon 222 coderen voor het aminozuur lysine, ongevoelig zijn voor scrapie. Binnen genoemd onderzoeksproject zijn in 2015 ruim duizend Nederlandse geiten onderzocht en ruim zes procent was drager van dit 222K allel. Een korte weergave van het onderzoek staat omschreven in
bijlage 1.
Geleidelijk is sindsdien meer informatie beschikbaar gekomen over de genetische ongevoeligheid van geiten voor scrapie en BSE. Duidelijk is dat geiten die 222K drager zijn, met andere woorden geiten die op codon 222 van het PrP gen (PRNP) coderen voor het aminozuur lysine, ongevoelig zijn voor scrapie en BSE. In iets mindere mate geldt hetzelfde voor geiten die 146D (asparaginezuur) en 146S (serine) drager zijn. Geiten met deze polymorfismen komen in Nederland niet vaak voor maar er zijn duidelijke verschillen tussen rassen: bij witte melkgeiten komt 222K bij minder dan 1% van de dieren voor, terwijl dit percentage bij Toggenburgers hoger is; bij Boergeiten komt 146S relatief vaak voor. Een toename van het aantal geteste dieren leidt in de nabije toekomst tot een beter overzicht van de genotypeverdeling bij verschillende rassen.
In juli 2020 is Richtlijn 999/2001 aangepast waardoor naast schapen met genotype ARR/ARR, geiten met 146D, 146S en 222K (‘caprine animals carrying at least one of the following alleles: K222, D146, S146) zonder verdere eisen wat betreft scrapie mogen deelnemen aan het intraverkeer. Naast genoemde polymorfismen komen bij geiten ook nog andere polymorfismen in het PRPN voor die in mindere mate coderen voor scrapieresistentie: 142M en 211Q (wildtypes zijn 142I, 146N, 211R en 222Q) maar met polymorfismen op de codonen 142 en 211 wordt geen rekening gehouden bij geiten die deelnemen aan het intraverkeer.
Samengevat is de situatie bij geiten als volgt.
Polymorfismen op de codonen 142, 146, 211 en 222 zijn van invloed op de scrapiegevoeligheid en codon 222 is daarbij het belangrijkst. Op codon 142 kunnen voorkomen I (isoleucine) en M (methionine); op codon 146 kunnen voorkomen N (asparagine), D (asparaginezuur) en S (serine), op codon 211 kunnen voorkomen R (arginine) en Q (glutamine) en op codon 222 Q (glutamine) en K (lysine).
Het wildtype is INRQ (= 142I, 146N, 211R, 222Q), het genotype dat oorspronkelijk bij geiten voorkomt. De andere vijf mogelijke varianten zijn mutaties van INRQ, waarbij normaal gesproken ten opzichte van INRQ slechts één van de vier codonen gemuteerd kan zijn. In totaal gaat het om de volgende zes varianten van het PrP-allel: INRQ, MNRQ, IDRQ, ISRQ, INQQ, INRK. Van deze zes varianten is INRQ het meest gevoelig voor scrapie en INRK het minst gevoelig.
Op grond van bovenstaande zijn in totaal 21 combinaties (= genotypen) mogelijk, die de gevoeligheid voor scrapie bij geiten bepalen. In het volgende schema staan de verschillende combinaties weergegeven:
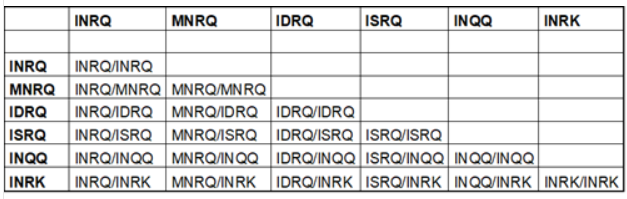
In 2020 is GD gestart met scrapie-genotypering van geiten om intraverkeer te faciliteren.
Gevoelige diersoorten
Scrapie behoort tot de TSE’s en tot deze groep van aandoeningen behoort ook BSE (bovine spongiform encephalopathy). BSE komt niet alleen bij het rund voor maar is bijvoorbeeld ook aangetoond bij een geit in Frankrijk. FSE (feline spongiform encephalopathy) is eigenlijk BSE bij katten en hetzelfde geldt voor vCJD (de jeugdvariant van Creutzfeldt-Jakob disease) bij de mens. Ander voorbeelden van TSE’s zijn kuru en Creutzfeldt-Jakob disease (CJD) bij de mens, chronic wasting disease (CWD) bij herten in Amerika en Canada en recent bij een rendier (Rangifer tarandus tarandus) in Noorwegen en transmissible mink encephalopathy (TME) bij nertsen. Een recente ontwikkeling is de publicatie in 2009 over de overdracht van BSE- en scrapieprionen naar zeebrasem (Dorade grise), hoewel daarover nadien niet meer is gepubliceerd.
Volksgezondheid
Scrapie wordt niet beschouwd als een zoönose: hoewel over prionziekten nog lang niet alles bekend is, zijn er geen aanwijzingen dat scrapie gevaarlijk is voor de mens.
Voor BSE is dat anders; de BSEepidemie in Groot-Brittannië, waarvan het eerste tipje van de sluier werd opgelicht door de beroemde publicatie van Wells et al. (Vet Rec. 1987 Oct 31;121(18):419-20. A novel progressive spongiform encephalopathy in cattle. Wells GA, Scott AC, Johnson CT, Gunning RF, Hancock RD, Jeffrey M, Dawson M, Bradley R.), heeft geleid tot heel veel onderzoek en daaruit is duidelijk geworden dat de nieuwe variant van de ziekte van Creutzfeldt-Jakob bij de mens (vCJD) een gevolg is van de opname van BSE-agens. Deze relatie tussen de ziektes BSE en vCJD, waarvan de eerste tien gevallen werden gerapporteerd in maart 1996, is nog steeds onderwerp van onderzoek. Ondertussen zijn in twaalf verschillende landen wereldwijd 230 vCJD gevallen bevestigd en dit aantal is waarschijnlijk een onderschatting van het werkelijke aantal maar een veel lager aantal dan het aantal dat aanvankelijk werd gevreesd. Om het risico op overdracht naar de mens zoveel mogelijk uit te sluiten, moeten slachthuizen hersenen, ruggenmerg, milt en ogen uit de karkassen van schapen, geiten en runderen ouder dan een bepaalde leeftijd verwijderen en laten vernietigen als “specifiek risicomateriaal”. De leeftijd van de dieren waarvoor dit geldt is in de loop van de jaren geleidelijk aangepast.
Totaal aantal vCJD gevallen wereldwijd (tot en met 28 mei 2015) (bron: http://www.eurocjd.ed.ac.uk).
Daarna zijn in 2016 nog twee gevallen bevestigd: één in het Verenigd Koninkrijk en één in Italië.
|
UK
|
3
|
10
|
10
|
18
|
15
|
28
|
20
|
17
|
18
|
9
|
5
|
5
|
5
|
2
|
3
|
3
|
5
|
0
|
1
|
0
|
177
|
|
France
|
0
|
1
|
0
|
0
|
0
|
1
|
1
|
3
|
0
|
2
|
6
|
6
|
3
|
0
|
2
|
0
|
0
|
0
|
1
|
1
|
27
|
|
Ireland
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
2
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4
|
|
Italy
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
2
|
|
USA
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
2
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
4
|
|
Canada
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
2
|
|
Saudi Arabia
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
1
|
|
Japan
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
|
Netherlands
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
3
|
|
Portugal
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
2
|
|
Spain
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
1
|
2
|
1
|
0
|
0
|
0
|
0
|
0
|
5
|
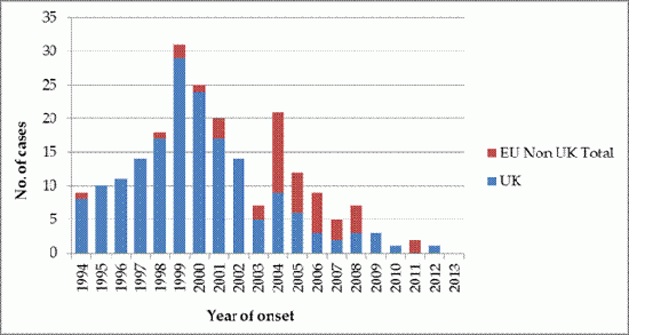
Aantal gerapporteerde (waarschijnlijke en bevestigde) gevallen van vCJD in de EU (op jaar van aanvang klachten).
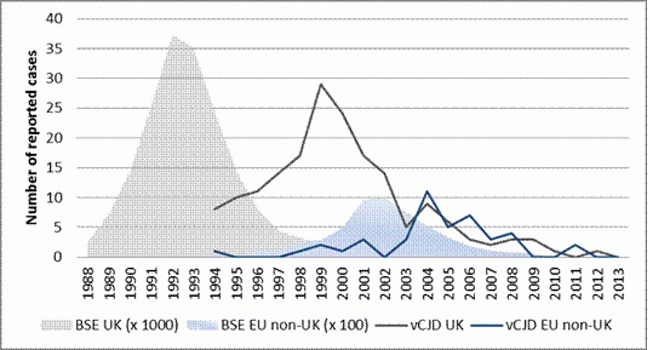
Aantal gerapporteerde (waarschijnlijke en bevestigde) gevallen van BSE en vCJD in de EU (op jaar van aanvang klachten).
(https://ecdc.europa.eu/en/vcjd/facts)
Desinfectie
Het prioneiwit is zeer resistent tegen verhitting (langer dan 30 minuten bij 3 bar) en de meeste desinfectiemiddelen. PrPSc is bijzonder resistent, niet alleen voor veelgebruikte ontsmettingsmiddelen en hoge temperaturen maar de eigen eiwitsplitsende enzymen van het schaap kunnen PrPSc ook maar moeilijk afbreken. Schapen maken continu PrPC aan en breken dit ook heel snel weer af. PrPSc is veel moeilijker afbreekbaar en hoopt zich daarom op in de cel. Hierdoor ontstaan celbeschadigingen en uiteindelijk gaat de cel verloren. Als deze cel een zenuwcel is kan dat op termijn leiden tot problemen van de kant van het zenuwstelsel.
Terug naar het begin van dit artikel
Na een vaak jarenlange incubatietijd treedt vacuolisatie op in de neuronen en de grijze massa van de hersenstam die bij histologisch onderzoek kan worden vastgesteld. Deze door stapeling van PrPSc veroorzaakte vacuolisatie gaat geleidelijk gepaard met afwijkend gedrag en vervolgens uitvalsverschijnselen bij de betreffende dieren. Na een slepend verloop eindigt de ziekte met de dood. De verschijnselen van scrapie treden in de regel op vanaf een leeftijd van anderhalf jaar. Er zijn klinische gevallen bekend van tien maanden oud en soms nog jonger, maar dat zijn uitzonderingen.
Klinische verschijnselen
Symptomen
Meestal zijn de schapen of geiten ouder dan twee jaar en vertonen ze de volgende verschijnselen:
- Afwijkend gedrag
- Jeuk, schuren
- Neurologische verschijnselen:
- trillingen aan de kop
- schrikgedrag
- Vermagering
Afwijkend gedrag
De eerste verschijnselen van scrapie bestaan vaak uit een verandering in gedrag. Soms kunnen de dieren tijdenlang staan te ‘dromen’ met de kop een beetje naar beneden. Op een ander moment vertoont het dier geen verschijnselen. In een koppel schapen waar scrapie voorkomt, kan een eigenaar soms in een zeer vroeg stadium een ziek dier onderkennen omdat het dier geen koppelgedrag meer vertoont. Als bijvoorbeeld de rest van de dieren weidt, ligt het scrapieschaap of loopt het dier alleen in de andere hoek van de wei.
Jeuk
In eerste instantie komen soms alleen verschijnselen van jeuk (to scrape = jeuken, schuren) voor. Aangedane dieren schuren zich aan van alles. Hierdoor kunnen veranderingen aan wol of huid ontstaan. Vaak wordt ook geschuurd aan niet-bewolde lichaamsdelen. Bij het betasten van de lendenstreek gaan de dieren vaak smakken. Naar schatting vertoont ongeveer zestig procent van de schapen met scrapie jeuk.
Neurologische verschijnselen
Schapen die lijden aan scrapie kunnen, naast andere neurologische verschijnselen, onrustig en schrikachtig zijn. Soms trillen ze over het hele lichaam. De Franse naam voor scrapie is dan ook ‘la tremblante’ (= trillen, beven). Vaak is het trillen alleen aan de kop goed te zien. Ook de bewegingen van het dier zijn veranderd. Zeker als het dier zich wat sneller verplaatst, doen de bewegingen denken aan die van een draver. De Duitsers spreken daarom van ‘Traberkrankheit’.
Vermagering
Naast bovengenoemde verschijnselen vermageren de dieren uiteindelijk en wordt de vacht dor en grauw. Een behandeling is niet mogelijk. Alle aangedane dieren gaan uiteindelijk dood. Bij sectie is het kadaver vaak mager; soms zijn huid- en vachtveranderingen aanwezig.
Morbiditeit/mortaliteit
De morbiditeit is over het algemeen laag maar verschilt sterk per ras of genotype maar ook sterk per land. De mortaliteit is uiteindelijk 100%.
Uitscheiding van het agens
Besmetting vindt onder natuurlijke omstandigheden meestal plaats na opname via de bek. Het afweersysteem van het slijmvlies van de darmwand is zeer waarschijnlijk betrokken bij de opname van PrPSc door de darmwand. Bij gevoelige dieren vindt, in vergelijking met minder gevoelige dieren, de opname van PrPSc efficiënter plaats of vindt een betere ophoping plaats in de cellen van het afweersysteem van het darmslijmvlies.
Bij VRQ/VRQ-dieren vindt na opname van PrPSc eerst infectie plaats van de tonsillen en de Peyerse platen. Van daaruit vindt verdere verspreiding plaats, eerst naar de lymfklieren die de lymfe vanuit de tonsillen en de Peyerse platen afvoeren. Vermeerdering van PrPSc in het afweerapparaat gaat langzamer en is beperkter in verspreiding bij dieren met een minder gevoelig genotype. Bij dieren met ARR in het genotype komt deze manier van verspreiden niet of bijna niet voor. Dit klopt ook met de ervaringen uit het flankerend onderzoek dat in Nederland in het kader van het scrapiebestrijdingsprogramma is uitgevoerd. Heterozygoot ARR dieren waren tonsilbiopt-negatief, ook als ze bij microscopisch onderzoek van de hersenen wel besmet bleken te zijn. De besmetting van het zenuwstelsel met PrPSc vindt later plaats dan besmetting van het afweerapparaat en mogelijk zelfs vanuit het afweerapparaat. In het zenuwweefsel begint de besmetting in de darm; van daaruit vindt verdere verspreiding plaats. Via zenuwbanen in buik- en borstholte komt PrPSc in een later stadium voor in het ruggenmerg van borst- en lendenwervels en in het verlengde merg van de hersenen. Van daaruit verspreidt PrPSc zich verder door het zenuwstelsel. Vermeerdering van PrPSc in zenuwweefsel gaat langzamer en is beperkter in verspreiding bij dieren met een minder gevoelig genotype. Op gelijke tijdstippen na infectie was er altijd minder PrPSc in de minder gevoelige dieren in vergelijking met VRQ/VRQ-dieren.
Verspreiding van PrPSc kan ook plaatsvinden via de bloedbaan. Bij experimentele bloedtransfusies vanuit schapen die besmet zijn met scrapie of met BSE lukt het om een besmetting over te brengen.
Recentelijk heeft een Noorse onderzoeksgroep bevestigd dat vermeerdering van PrPSc langzamer gaat en beperkter is in verspreiding bij dieren met een minder gevoelig genotype. In dit experiment deden de eerste klinische verschijnselen bij een VRQ/VRQ-dier zich voor op een leeftijd van zeven maanden. Het uitgebreide vervolgonderzoek toonde bij één dier PrPSc aan in het hoornvlies van het oog en bij twee dieren in de nageboorte. Bij de mens zijn gevallen van de ziekte van Creutzfeldt-Jakob beschreven na hoornvliestransplantatie. Dat de nageboorte van met scrapie besmette schapen een rol speelt bij de overdracht van de infectie in een koppel is niet nieuw.
Bovenstaande geldt voor klassieke scrapie. Van de in 1998 gevonden variant NOR98 en de daarna gevonden atypische scrapie is veel minder bekend. Er loopt op een aantal plaatsen onderzoek naar deze vormen van scrapie. De laatste informatie daarover geeft aan dat deze atypische scrapie mogelijk onder experimentele omstandigheden wel overdraagbaar zou kunnen zijn maar onder natuurlijke omstandigheden niet besmettelijk is.
Differentiaaldiagnose
De differentiaaldiagnose voor scrapie omvat:
- Externe parasieten (luizen, schurftmijten) of jeuk door andere oorzaken;
- Ziekte van Aujeszky;
- Maedi-visna;
- Cerebrale listeriose;
- Acetonaemie;
- Rabiës (hondsdolheid);
- Cerebrocorticale necrose (polioencephalomalacia);
- Abcessen of tumoren in de hersenen;
- Louping-ill en andere tick-borne encephalitiden;
- Intoxicaties;
- Hypomagnesemie;
- Focale symmetrisch encephalomalacia (sublethale of chronische enterotoxemia), en andere degeneratieve ziekten van het centrale zenuwstelsel;
- BSE is gemeld bij experimenteel besmette schapen en een op natuurlijke wijze besmette geit.
Terug naar het begin van dit artikel
In het verbeteren van de diagnostiek is sinds de uitbraak van BSE heel veel energie gestoken. Inmiddels wordt bijna routinematig gebruik gemaakt van een speciale kleuring waarmee het PrPSc bij microscopisch onderzoek zichtbaar kan worden gemaakt. Hierdoor kan niet alleen een nog specifiekere diagnose worden gesteld maar kan de diagnose ook in een eerder stadium worden gesteld. Het is met deze techniek ook mogelijk de diagnose bij het levende dier te stellen door de kleuring toe te passen op een tonsilbiopt. Daarbij is gebleken dat VRQ/VRQ-dieren tonsiltest-positief kunnen zijn vanaf een leeftijd van vier maanden; dieren met resistentere genotypen worden later of niet tonsilbiopt-positief. De tonsiltest wordt positief op eenderde tot de helft van de normale incubatietijd die bij een bepaald genotype hoort.
Diagnose
Bij een vergevorderd en typisch scrapiegeval kan een ervaren iemand na een intensieve observatie met een grote mate van zekerheid de diagnose aan het levende dier stellen. Microscopisch onderzoek van de hersenen is echter nodig om de diagnose te bevestigen. In het verbeteren van de diagnostiek is sinds de uitbraak van BSE heel veel energie gestoken. Met een speciale kleuring is het nu mogelijk om het PrPSc bij microscopisch onderzoek zichtbaar te maken. Hierdoor kan niet alleen een nog specifiekere diagnose worden gesteld maar kan de diagnose ook in een eerder stadium worden gesteld. Op basis van deze techniek kan de diagnose ook aan het levende dier worden gesteld.
Pathologie
Vooralsnog is voor de scrapie-diagnose materiaal van het centraal zenuwstelsel nodig. Daarmee worden de mogelijkheden per definitie beperkt tot post-mortale diagnostiek. De op dit moment beschikbare testen voor het aantonen van BSE zijn gevalideerd op materiaal van klinische gevallen. In november 2012 heeft Prionics laten weten een nieuwe test te hebben ontwikkeld (Prionics-Check Priostrip sr) die ook in het preklinisch stadium BSE en scrapie aan zou kunnen tonen. Wel zijn grote verschillen tussen testen gevonden voor wat betreft de detectiegrens in verdunningsreeksen van hersensuspensies, suggererend dat sommige testen beter in staat zijn preklinische stadia op te sporen dan andere. BSE tast vooral de grijze stof in de hersenen aan, waarbij de hoogste concentraties aan pathogene prionen worden gevonden in de hersenstam. Met name ter hoogte van de obex, het overgangsgebied naar het centraal kanaalventrikel, liggen enkele zenuwkernen waarin pathogene prionen accumuleren. In dit gebied worden ook de duidelijkste afwijkingen gevonden bij histopathologisch onderzoek. Het pathogene proteinase-resistente prion wordt niet afgebroken en accumuleert als aggregaten in het cytoplasma van neuronen in de vorm van scrapie associated fibrils (SAFs). Deze fibrillen zijn goed te herkennen onder een elektronenmicroscoop.
Isolatie van de kiem
Isolatie van de kiem is niet mogelijk.
Overige testen
DNA-test
De gevoeligheid voor scrapie is voor een deel erfelijk bepaald. Waarschijnlijk wordt dit door één enkel gen, het PrP-gen, gecontroleerd.
Structuur PrP-gen
Op het PrP-gen komen 256 posities of codonen voor. Elk codon codeert voor een aminozuur, een bouwsteen voor eiwitten. Bij schapen zijn veranderingen aan de codonen 136, 154 en 171 met name van invloed op de scrapiegevoeligheid.
Op codon 136 kunnen voorkomen A (alanine) en V (valine); op codon 154 kunnen voorkomen R (arginine) en H (histidine) en op codon 171 vooral R (arginine) en Q (glutamine). Vier varianten van het PrP-gen zijn van belang: VRQ (= 136 V, 154 R en 171 Q), ARQ, AHQ en ARR.
Het wildtype is ARQ, het genotype dat oorspronkelijk bij schapen voorkomt.
De andere drie varianten zijn mutaties van ARQ, waarbij normaal gesproken ten opzichte van ARQ slechts één van de drie codonen gemuteerd kan zijn. Van deze vier varianten is VRQ het meest gevoelig voor scrapie en ARR het minst gevoelig. In aflopende gevoeligheid voor scrapie is de volgorde zoals hierboven is vermeld: VRQ, ARQ, AHQ en ARR.
Voor BSE bij schapen geldt in grote lijnen hetzelfde. Schapen met genotype ARQ/ARQ zijn het gevoeligst voor BSE. Schapen met genotype ARR/ARR zijn ongevoelig voor BSE.
Mogelijke uitslagen van het onderzoek
Op grond van bovenstaande zijn in totaal tien combinaties (= genotypen) mogelijk, die de gevoeligheid voor scrapie bepalen. In het volgende schema staan de verschillende combinaties weergegeven:
| VRQ |
VRQ/VRQ |
|
|
|
| ARQ |
VRQ/ARQ |
ARQ/ARQ |
|
|
| AHQ |
VRQ/AHQ |
ARQ/AHQ |
AHQ/AHQ |
|
Rasverschillen
Niet elk schapenras is even gevoelig voor de ziekte scrapie en tevens komen niet bij alle rassen de tien mogelijke genotypen voor. Rassen waar alle genotypen voorkomen, zijn onder meer de Swifter en de Texelaar. Daarentegen komen bij bepaalde rassen maar drie of vier mogelijke combinaties voor.
Een Texelaar met genotype VRQ/VRQ is het meest gevoelig voor scrapie, terwijl een Texelaar met het genotype ARR/ARR resistent is voor scrapie. Tussen deze uitersten resteren acht genotypen die eveneens een bepaalde mate van (on)gevoeligheid voor scrapie aangeven. Deze mate van (on)gevoeligheid is enigszins af te leiden uit de mate van gevoeligheid van de vier varianten die hierboven is aangegeven. Aan het begin van dit artikel staat uitleg over de genetische ongevoeligheid voor scrapie bij geiten.
Tonsiltest
Naast de hiervoor genoemde DNA-test bestaat een tonsiltest waarmee bij het levende dier de diagnose scrapie kan worden gesteld. Deze test is gebaseerd op een speciale kleuring van een tonsilbiopt waarmee het PrPSc bij microscopisch onderzoek zichtbaar kan worden gemaakt.
Hersenonderzoek
Histopathologisch onderzoek van de hersenen laat bilateraal symmetrische, degeneratieve veranderingen zien in delen van de grijze substantie van de hersenstam. Zowel in de neuropil als intraneuronaal worden vacuolen aangetroffen. Door bij histologisch onderzoek gebruik te maken van de kleuring waarmee het PrPSc bij microscopisch onderzoek zichtbaar kan worden gemaakt, is de nauwkeurigheid van de diagnostiek aanmerkelijk verbeterd.
Bij elektronen-microscopisch onderzoek van de hersenen kunnen verder bepaalde fibrillen (SAF’s: scrapie associated fibrils) worden aangetoond.
Terug naar het begin van dit artikel
Nederland
Op basis van een in 1992 uitgevoerd onderzoek kwam scrapie in Nederland naar schatting voor op ruim 6% van de bedrijven met schapen. In geïnfecteerde koppels lag het aantal klinische gevallen op ruim één procent per jaar. Door gericht op scrapie-ongevoeligheid te fokken is in de jaren daarna het aantal besmette dieren en bedrijven in ons land duidelijk gedaald. In 2002 werden twee scrapiegevallen per duizend geteste schapen aangetoond; het totale aantal bevestigde gevallen was 40. In de jaren 2003, 2004, 2005, 2006, 2007 en 2008 waren dat er respectievelijk 51, 40, 35, 38, 23 en 11. Daarna is dat aantal verder gedaald naar minder dan één scrapiegeval gemiddeld per jaar in de hele Nederlandse schapenstapel in de laatste twaalf jaar. In de jaren 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018, 2019 en 2020 zijn respectievelijk maar drie, twee, één, nul, twee, en verder nul positieve gevallen per jaar gedetecteerd. Hoewel over scrapie bij geiten veel minder bekend is, gaan we ervan uit dat scrapie bij de geit in Nederland niet of bijna niet voorkomt. Het laatste geval bij geiten dateert van 2001.
Andere landen
De incidentie van scrapie is verschillend per land. Beschreven verschillen kunnen ook te maken hebben met verschillen in monitoringssystematiek tussen verschillende landen. Tussen verschillende rassen komen ook verschillen voor in de mate van voorkomen van deze ziekte, deels afhankelijk van verschillen in genotypefrequenties. Scrapie komt in heel veel landen zelden voor bij geiten maar bijvoorbeeld op het eiland Cyprus hebben zich juist bij geiten grote problemen voorgedaan. Gedurende een aantal jaren was het hier niet toegestaan om schapen en geiten te consumeren.
Naar aanleiding van de ontwikkelingen rond BSE in de rundveehouderij in het Verenigd Koninkrijk en de mogelijkheid dat BSE ook in schapen voor zou kunnen komen, zijn in Nederland overheid en bedrijfsleven in de loop van de jaren negentig van de vorige eeuw gestart met de bestrijding van scrapie bij schapen door te fokken op resistentie. De meeste fokkerijorganisaties van schapen hebben toen in eerste instantie rammen en later ook ooien laten genotyperen en vervolgens in toenemende mate dieren met het scrapieresistente genotype ARR/ARR ingezet in de fokkerij. Dit heeft er in geresulteerd dat de genotypeverdeling sinds de start van de bestrijding geleidelijk zo is veranderd dat een per ras verschillend deel van de fokkerijpopulatie scrapieresistent is geworden.
De scrapiebestrijding bij schapen in Nederland mag succesvol worden genoemd, ondanks het feit dat in juni 2007 de verplichting om sectorbreed te fokken op resistentie enkele jaren te vroeg is afgeschaft. Het aantal gevallen van klassieke scrapie per jaar nadert in Nederland desondanks de nul.
Het Verenigd Koninkrijk heeft in 2001 een zogenaamd National Scrapie Plan opgezet en gedurende een aantal jaren uitgevoerd. Mede door beperkingen in financiële middelen is deze aanpak eerder gestopt dan bij de start was voorzien. Op 1 oktober 2001 is ook in Frankrijk een selectieprogramma gestart op basis van selectie op erfelijke ongevoeligheid. Dit programma is verplicht gesteld voor alle fokkerijorganisaties die door de Franse overheid worden ondersteund. Het is niet duidelijk waartoe dit uiteindelijk heeft geleid. Hoe de situatie in de andere lidstaten van de EU is, is niet precies bekend, hoewel alle Europese lidstaten aan het begin van de eenentwintigste eeuw bij de EU een scrapiefokprogramma in hebben moeten dienen. In veel landen is echter van de bestrijding niet heel veel terechtgekomen. Er bestaan plannen om de aanpak op Europees niveau weer te gaan stimuleren. Of daar veel van terecht zal komen is moeilijk te voorspellen.
Evenals in Nederland bestaat in het Verenigd Koninkrijk een scrapiebewakingsprogramma op grond van richtlijn 91/68/EEG en dus op basis van de TSEverordening 999/2001.
In verschillende landen buiten de EU zijn de afgelopen decennia ook scrapiebestrijdingsprogramma’s gestart maar de uitkomsten daarvan zijn niet bekend.
Meldingsplichtig
Scrapie is een meldingsplichtige ziekte volgens artikel 15 van de Gezondheids- en Welzijnswet voor Dieren. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA. Aanpak van besmette bedrijven gaat volgens de dan geldende draaiboeken.
Vaccinatie
Niet van toepassing.
Antibiotica
Niet van toepassing.
Overige maatregelen
Scrapiebestrijdingsprogramma
Op 1 juli 1998 is in de Nederlandse schapenhouderij de scrapiebestrijding van start gegaan op basis van selectie op erfelijke ongevoeligheid voor deze ziekte. Het doel van de bestrijding was om binnen tien jaar zoveel ongevoelige fokrammen te hebben gefokt dat alle schapenhouders in ons land een resistente ram als dekram in zouden kunnen zetten. De toenemende zorg voor TSE’s heeft het in 2002 noodzakelijk gemaakt om dit programma te versnellen. Het einddoel is toen vier jaar naar voren gehaald. Daarom zijn in 2004 alle schapenhouders met tien en meer ooien verplicht om een resistente dekram in te zetten. Een jaar later is deze verplichting ook ingegaan voor de kleine bedrijven. Uitzonderingen op deze verplichting bestaan er voor een klein aantal schapenfokkers die lid zijn van een fokkerijorganisatie met een ras met een lage ARRfrequentie. Voor deze rassen is een speciaal fokprogramma ontwikkeld dat selectie op scrapieongevoeligheid bevordert zonder dat sprake is van een te grote inteelttoename.
De brede inzet van resistente rammen heeft geresulteerd in een snelle afname van de gevoeligheid voor scrapie en BSE (dieren met genotype ARR/ARR zijn niet alleen resistent voor scrapie maar ook voor BSE) en daarmee in een afname van het aantal scrapiegevallen. Uiteindelijk zou dit, bij ongewijzigd beleid, tot de eradicatie van klassieke scrapie in Nederland kunnen leiden. Met de huidige kennis van zaken is fokken op scrapieresistentie nog steeds de beste manier om van de aandoening af te komen. Toch is in juni 2007 besloten om de verplichting om resistente fokrammen als dekram in te zetten af te schaffen.
Indeling programma
De bestrijding richt zich op het selecteren van fokdieren die ongevoelig zijn voor scrapie. Deze (on)gevoeligheid voor scrapie is erfelijk bepaald en kan worden vastgesteld aan de hand van bloedonderzoek.
Het scrapiebestrijdingsprogramma is vanaf 1998 als project uitgevoerd door GD. Vanaf 1 januari 2006 voerde GD dit programma verder zelfstandig uit op basis van een GD scrapie-reglement. De regelgeving op basis waarvan alle schapenbedrijven in ons land verplicht waren om een resistente ram als dekram in te zetten is via het ministerie van Landbouw, Natuur en Voedselkwaliteit (tegenwoordig: Economische Zaken (EZ)) in medebewind ondergebracht bij het Productschap Vlees en Vee (PVV). In juni 2007 is deze verplichting afgeschaft. Scrapiebestrijding vindt tegenwoordig weer plaats op basis van een GD-scrapiereglement.
Deelname
Deelname aan het programma is mogelijk voor alle schapenhouders in ons land. De deelnemers hebben een aantal verplichtingen. Zij moeten hun dieren binnen zeven dagen na de geboorte van een officieel toegelaten oormerk voorzien en hun dieren laten registreren in de centrale I&R-database die gekoppeld is met het Individueel DierRegistratiesysteem (IDR), het computerprogramma van GD voor de individuele dierregistratie.
Nadat deelnemers hebben aangegeven dat zij dieren willen laten genotyperen, stuurt GD barcodestickers (met individuele diernummers) naar de dierenarts van de schapenhouder en een brief naar de schapenhouder dat hij contact moet opnemen met zijn dierenarts om een afspraak te maken. Zodra de dierenarts van de schapenhouder de barcodestickers heeft ontvangen, kan hij bloed afnemen van de gewenste dieren en deze barcodestickers aanbrengen op de bloedbuizen. Bloedmonsters die zonder barcodestickers worden ingezonden worden niet onderzocht omdat de kans op fouten veel groter is dan bij bloedmonsters mét barcodestickers. De monsterverwerking vindt namelijk voor het grootste deel geautomatiseerd plaats op basis van deze barcodestickers.
Status scrapiebestrijding
Deelnemende schapenhouders mogen per keer zelf beslissen welke dieren zij willen laten onderzoeken. Zodra op een bedrijf alle dieren genotype ARR/ARR hebben, kan de schapenhouder de status scrapie-resistent aanvragen. Voor GD die status toekent wordt het bedrijf door of namens de GD bezocht om te controleren of de situatie op papier overeenkomt met de werkelijkheid. Na het toekennen van de status scrapie-resistent vindt steekproefsgewijs controle op deze status plaats. Daarbij wordt per keer van enkele nader te bepalen dieren het op papier verstrekte genotype van ARR/ARR gecontroleerd.
Diercertificaat
Naast de bedrijfscertificering is eind 2002 een start gemaakt met de diercertificering. Voor alle rammen en ooien met genotype ARR/ARR kan de deelnemende schapenhouder een diercertificaat krijgen. Het scrapiebestrijdingsprogramma is gebaseerd op Europese regelgeving en is voor Nederland uitgewerkt in het ‘Reglement scrapiebestrijding 2007’.
Scrapiebewakingsprogramma
Sinds 1992 kunnen schapen- en geitenhouders deelnemen aan het scrapiebewakingsprogramma van GD. Dit programma is gebaseerd op Europese regelgeving en is voor Nederland uitgewerkt in het ‘Reglement scrapiebewaking’. In 2015 is daarvan een nieuwe versie verschenen, aangepast aan nieuwe Europese regelgeving en wensen van de NVWA. GD houdt voor deelnemers essentiële informatie bij en bij intraverkeer of bij export wordt die informatie gedeeld met de NVWA. Op basis daarvan besluit de NVWA of dieren van het betreffende bedrijf mogen deelnemen aan het intraverkeer of mogen worden geëxporteerd.
Bedrijven die aan dit programma deelnemen moeten:
- Voldoen aan de bepalingen van de geldende I&R-regeling schapen en geiten;
- De dieren individueel identificeren en registreren volgens de aanwijzingen van GD;
- Jaarlijks hersenonderzoek laten uitvoeren: één procent van de ooien (minimaal één ooi) moet jaarlijks worden onderzocht. De voor onderzoek aangewezen ooien moeten twee jaar oud zijn en op het bedrijf zijn geboren of daar minimaal twee jaar hebben verbleven. Voor bedrijven met twintig ooien of minder is er een regeling om in plaats van onderzoek van één kop per jaar de koppen van alle uitstootooien voor onderzoek aan te bieden, met een minimum van één kop per twee jaar. Voor geiten gelden dezelfde eisen.
Schapenhouders die dieren naar een andere EU lidstaat willen verkopen kunnen dat zonder problemen doen met dieren met genotype ARR/ARR. Voor andere schapen gelden andere regels die in de loop van de jaren verschillende keren zijn aangepast. De recente regelgeving is als volgt door de NVWA vertaald (daar waar fokgeiten resp. mestgeiten resp. geiten staat kan ook fokschapen resp. mestschapen resp. schapen worden gelezen indien het schapen betreft die niet ARR/ARR zijn):
De regels voor export liggen vast in Europese regelgeving. Indien schapen ARR/ARR zijn voldoen ze daarmee aan de scrapieeisen bij export en doet de bedrijfsstatus er niet toe. Voor schapen die niet ARR/ARR zijn gelden de voorwaarden voor geiten die hieronder zijn beschreven. Bij geiten zijn geen ARR/ARRdieren en gelden onderstaande voorwaarden. Voor de export van fokgeiten heeft het herkomstbedrijf altijd een scrapiestatus nodig en in geval van export van mestgeiten (zie richtlijn 91/68 EU) naar bepaalde lidstaten ook. Welke status een bedrijf nodig heeft bij export hangt af van de categorie te exporteren geiten en de bestemming. Nadere informatie daarover is te verkrijgen bij de NVWA. Voor de status verwaarloosbaar risico moet het bedrijf minimaal 7 jaar aan de onderstaande voorwaarden voldoen. Voor de status gecontroleerd risico moet het bedrijf minimaal 3 jaar aan de onderstaande voorwaarden voldoen. Deze voorwaarden zijn:
- NVWA voert jaarlijks een diergeneeskundige controle uit op het bedrijf.
- De geiten zijn op de correcte wijze geïdentificeerd.
- Er zijn geen gevallen van scrapie vastgesteld.
- Het bedrijf heeft deelgenomen aan het koppenonderzoek van GD.
- Alle uitslagen van het onder 4 genoemde onderzoek zijn negatief.
- Aanvoer.
A) Levende dieren: de fokgeiten zijn geboren op het desbetreffende bedrijf of zijn aangevoegd van een geitenbedrijf met minimaal een gelijkwaardige status.
B) Embryo's en eicellen en sperma: nadere informatie daarover is te krijgen bij de NVWA
- De geiten van het bedrijf hebben geen (in)direct contact, met inbegrip van gemeenschappelijk gebruik van weiden, met schapen of geiten van een bedrijf met een lagere status.
NVWA controleert eenmaal per jaar bovenstaande punten en bij een volgende exportcertificering ook op de aanvoer na de laatste controle. Indien er geen tekortkomingen zijn dan wordt de status toegekend door de NVWA. Uiteraard gelden naast deze eisen voor scrapie ook de andere eisen zoals de enkele en dubbele 21 dagen regeling enzovoorts. Zie voor meer informatie op www.nvwa.nl.
In juli 2020 is Richtlijn 999/2001 aangepast waardoor naast schapen met genotype ARR/ARR, geiten met 146D, 146S en 222K (‘caprine animals carrying at least one of the following alleles: K222, D146, S146) zonder verdere eisen wat betreft scrapie mogen deelnemen aan het intraverkeer.
Terug naar het begin van dit artikel
Echte preventie in de zin zoals dat bij andere ziekten van toepassing is, is bij scrapie niet mogelijk. De beste preventie tot nu toe is fokken op resistentie gebleken.
Sinds 23 juli 1998 geldt een aangifteplicht voor scrapie op grond van artikel 15 van de Gezondheids- en Welzijnswet voor Dieren. Dit betekent dat houders van kleine herkauwers en hun dierenartsen verplicht zijn om van scrapie verdachte dieren te melden bij de NVWA. Sinds 1 januari 2001 is bij een verdenking het scrapiedraaiboek van de NVWA van toepassing. Dit draaiboek wordt met regelmaat aangepast aan nieuwe Europese regelgeving en is ook van toepassing op scrapiegevallen die afkomstig zijn van monitoring bij slachthuizen en bij de destructor.
Na een melding bezoekt een deskundigenteam het van scrapie verdachte bedrijf om het dier te beoordelen. Wanneer scrapie niet kan worden uitgesloten, wordt het verdachte dier overgenomen en nader onderzocht bij WBVR in Lelystad. Als de diagnose scrapie bij het overgenomen dier wordt bevestigd, wordt het bedrijf officieel besmet verklaard.
Het bedrijf komt dan officieel onder toezicht van de NVWA. Dit toezicht blijft van kracht tot drie jaar na het laatst bevestigde geval van scrapie.
Schapenhouders die te maken krijgen met een scrapiebesmetting zijn verplicht om alleen scrapieresistente (ARR/ARR) rammen als dekram in te zetten.
Handelsrichtlijn kleine herkauwers
Scrapie werd genoemd in artikel 6 van richtlijn 91/68/EEG, de handelsrichtlijn voor kleine herkauwers. Deze richtlijn is ingrijpend gewijzigd (richtlijn 2003/50/EG van de Raad van 11 juni 2003 tot wijziging van Richtlijn 91/68/EEG met betrekking tot de intensivering van de controles op verplaatsingen van schapen en geiten) en de tekst van artikel 6 is overgeplaatst naar de TSE-verordening (999/2001), die sinds 1 juli 2001 van kracht is. Voor het intracommunautaire handelsverkeer moeten fokschapen en -geiten wat scrapie betreft afkomstig zijn van een bedrijf dat voldoet aan de volgende eisen:
- Het bedrijf staat onder officieel toezicht overeenkomstig artikel 3, lid 1, onder b) van Richtlijn 90/425/EEG;
- De dieren zijn geoormerkt volgens de geldende I&R-regeling voor kleine herkauwers;
- Sedert ten minste drie jaar is geen enkel geval van scrapie bevestigd;
- Er moet een steekproefsgewijze controle worden verricht op voor de uitstoot bestemde oudere ooien afkomstig van dit bedrijf;
- Aankoop van vrouwelijke dieren mag alleen plaatsvinden van een bedrijf dat aan dezelfde voorwaarden voldoet;
- In richtlijn 999/2001 is de volgende mogelijkheid toegevoegd: schapen met genotype ARR/ARR mogen, als zij aan de overige exporteisen van richtlijn 2003/50/EG voldoen, zonder beperkingen deelnemen aan het intracommunautaire verkeer. Ze hoeven in dat geval dus niet afkomstig te zijn van een bedrijf dat deelneemt aan het scrapiebewakingsprogramma.
Per januari 2015 heeft een aantal EU-lidstaten de voorwaarden waaronder kan worden geïmporteerd aangepast: zie hiervoor onder hoofdstuk aanpak besmette bedrijven.
Terug naar het begin van dit artikel
Websites
Literatuur
Vet Res. 2017 Sep 19;48(1):52. doi: 10.1186/s13567-017-0455-0.
Protecting effect of PrP codons M142 and K222 in goats orally challenged with bovine spongiform encephalopathy prions.
Fast C, Goldmann W, Berthon P, Tauscher K, Andréoletti O, Lantier I, Rossignol C, Bossers A, Jacobs JG, Hunter N, Groschup MH, Lantier F, Langeveld JPM.
Abstract
Breeding towards genetic resistance to prion disease is effective in eliminating scrapie. In sheep, classical forms of scrapie have been eradicated almost completely in several countries by breeding programs using a prion protein (PrP) gene (PRNP) amino acid polymorphism. For goats, field and experimental studies have provided evidence for several amino acid polymorphisms that are associated with resistance to scrapie, but only limited data are available concerning the susceptibility of caprine PRNP genotypes to BSE. In this study, goat kids representing five PRNP genotypes based on three polymorphisms (M142, Q211 and K222 and the wild type I142, R211 and Q222) were orally challenged with bovine or goat BSE. Wild type goats were killed with clinical signs between 24-28 months post inoculation (mpi) to both challenges, and goats with genotype R/Q211 succumbed between 29-36 mpi. I/M142 goats developed clinical signs at 44-45 mpi and M/M142 goats remained healthy until euthanasia at 48 mpi. None of the Q/K222 goats showed definite clinical signs. Taken together the highest attack ratios were seen in wild type and R/Q211 goats, and the lowest in I/M142, M/M142 and Q/K222. In all genotype groups, one or more goats remained healthy within the incubation period in both challenges and without detectable PrP deposition in the tissues. Our data show that both the K222 and M142 polymorphisms lengthen the incubation period significantly compared to wild type animals, but only K222 was associated with a significant increase in resistance to BSE infection after oral exposure to both BSE sources.
J Gen Virol. 2017 Sep 18. doi: 10.1099/jgv.0.000906. [Epub ahead of print]
Experimental transmission to a calf of an isolate of Spanish classical scrapie.
Bolea R, Hedman C, López-Pérez Ó, Marín B, Vidal E, Pumarola M, Corbière F, Romero A, Moreno B, Martín-Burriel I, Andréoletti O, Badiola JJ.
Abstract
Multiple theories exist regarding the origin of bovine spongiform encephalopathy (BSE). An early and prominent theory proposed that BSE was the result of the adaptation of sheep scrapie to cattle. The reports to date indicate that the distribution of the pathological prion protein (PrPSc) in experimental bovine scrapie is largely restricted to the central nervous system (CNS). Here, we describe pathological findings in a calf intracerebrally inoculated with a Spanish classical scrapie isolate. While clinical disease was observed 30 months after inoculation and PrPSc was detected in the CNS, the corresponding phenotype differed from that of BSE. Immunohistochemistry and PMCA also revealed the presence of PrPSc in the peripheral nerves, lymphoid tissues, skeletal muscle and gastrointestinal tract, suggesting centrifugal spread of the scrapie agent from the brain. To the best of our knowledge, this is the first report describing the detection of PrPSc in tissues other than the CNS after experimental transmission of scrapie to cattle.
Euro Surveill. 2017 Aug 10;22(32). pii: 30594. doi: 10.2807/1560-7917.ES.2017.22.32.30594.
Evidence for more cost-effective surveillance options for bovine spongiform encephalopathy (BSE) and scrapie in Great Britain.
Wall BA, Arnold ME, Radia D, Gilbert W, Ortiz-Pelaez A, Stärk KD, Van Klink E, Guitian J.
Abstract
Transmissible spongiform encephalopathies (TSEs) are an important public health concern. Since the emergence of bovine spongiform encephalopathy (BSE) during the 1980s and its link with human Creutzfeldt-Jakob disease, active surveillance has been a key element of the European Union's TSE control strategy. Success of this strategy means that now, very few cases are detected compared with the number of animals tested. Refining surveillance strategies would enable resources to be redirected towards other public health priorities. Cost-effectiveness analysis was performed on several alternative strategies involving reducing the number of animals tested for BSE and scrapie in Great Britain and, for scrapie, varying the ratio of sheep sampled in the abattoir to fallen stock (which died on the farm). The most cost-effective strategy modelled for BSE involved reducing the proportion of fallen stock tested from 100% to 75%, producing a cost saving of ca GBP 700,000 per annum. If 50% of fallen stock were tested, a saving of ca GBP 1.4 million per annum could be achieved. However, these reductions are predicted to increase the period before surveillance can detect an outbreak. For scrapie, reducing the proportion of abattoir samples was the most cost-effective strategy modelled, with limited impact on surveillance effectiveness.
J Gen Virol. 2017 Aug;98(8):2200-2204. doi: 10.1099/jgv.0.000861. Epub 2017 Jul 19.
Classical scrapie transmission in ARR/ARR genotype sheep.
Lacroux C, Cassard H, Simmons H, Yves Douet J, Corbière F, Lugan S, Costes P, Aron N, Huor A, Tillier C, Schelcher F, Andreoletti O.
Abstract
The ARR allele is considered to provide a very strong resistance against classical scrapie infection in sheep. In this study, we report the occurrence of clinical transmissible spongiform encephalopathy in ARR/ARR sheep, following their inoculation by the intracerebral route with a classical scrapie isolate. On first passage, the disease displayed an incomplete attack rate transmission, with incubation periods exceeding 6 years. On second passage, the obtained prion did not display better abilities to propagate than the original isolate. These transmission results contrasted with the 100 % attack rate and the short incubation periods observed in ARQ/ARQ sheep challenged with the same isolate. These data confirm that ARR/ARR sheep cannot be considered to be fully resistant to classical scrapie. However, they also support the contention that classical scrapie has a very limited capacity to transmit and adapt to ARR/ARR sheep.
Vet Rec. 2017 Apr 22;180(16):403. doi: 10.1136/vr.103762. Epub 2017 Feb 17.
Case-control study on the use of pituitary-derived hormones from sheep as a potential risk factor for the occurrence of atypical scrapie in Great Britain.
Marier E, Dawson M, Simmons M, Hope J, Ortiz-Peláez A.
Abstract
A case-control study was conducted in 2013 to investigate the use of pituitary-derived hormones from sheep as a potential risk factor for the presence of atypical scrapie in Great Britain sheep holdings. One hundred and sixty-five holdings were identified as cases. Two equal sets of controls were selected: no case of scrapie and cases of classical scrapie. A total of 495 holdings were selected for the questionnaire survey, 201 responses were received and 190 (38.3 per cent) were suitable for analysis. The variables 'use-of-heat-synchronisation/superovulation' and 'flock size' were significantly associated with the occurrence of atypical scrapie. Farms with atypical cases were less likely (OR 0.25, 95 per cent CI 0.07 to 0.89) to implement heat synchronisation/superovulation in the flock than the control group. Atypical cases were 3.3 times (95 per cent CI 1.38 to 8.13) more likely to occur in large holdings (>879 sheep) than in small flocks (<164 sheep). If the 'use-of-heat-synchronisation/superovulation' is a proxy for the use of pituitary-derived hormones, the significant negative association between having a case of atypical scrapie and the use of these practices rules out the initial hypothesis that using these drugs is a risk factor for the occurrence of atypical scrapie. Flock size was a significant risk factor for atypical scrapie, consistent with a previous generic case-control study
J Vet Diagn Invest. 2017 Mar;29(2):232-236. doi: 10.1177/1040638716688045. Epub 2017 Jan 9.
EU-approved rapid tests might underestimate bovine spongiform encephalopathy infection in goats.
Meloni D, Bozzetta E, Langeveld JP, Groschup MH, Goldmann W, Andrèoletti O, Lantier I, Van Keulen L, Bossers A, Pitardi D, Nonno R, Sklaviadis T, Ingravalle F, Peletto S, Colussi S, Acutis PL.
Abstract
We report the diagnostic sensitivity of 3 EU-approved rapid tests (ELISAs; 1 from IDEXX and 2 from Bio-Rad) for the detection of transmissible spongiform encephalopathy diseases in goats. Ninety-eight goat brainstem samples were tested. All the rapid tests had 100% specificity and ≥80% sensitivity, with the IDEXX test significantly more sensitive than the 2 Bio-Rad tests. All tests detected 100% of samples from goats with clinical scrapie, but missed 8% (IDEXX) to 33% (Bio-Rad SG) of samples from preclinical goats. Importantly, only IDEXX picked up all samples from clinical bovine spongiform encephalopathy (BSE)-infected goats, whereas the other 2 rapid tests missed 15% (Bio-Rad SG) to 25% (Bio-Rad SAP). These results show that a fraction of preclinical scrapie infections are likely missed by EU surveillance, with sensitivity of detection strongly dependent on the choice of the rapid test. Moreover, a significant proportion of clinical BSE infections are underestimated by using either Bio-Rad test. Assuming that the same sensitivity on preclinical goats would also occur in BSE-infected goats, our data suggest that IDEXX is likely the most sensitive test for detecting preclinical field cases of BSE infection in goats, although with an 8% failure rate. These results raise some concerns about the reliability of current EU surveillance figures on BSE infection in goats.
J Vet Med Sci. 2017 Jan 10;78(12):1915-1919. doi: 10.1292/jvms.16-0379. Epub 2016 Sep 11.
Identification of the first case of atypical scrapie in Japan.
Imamura M, Miyazawa K, Iwamaru Y, Matsuura Y, Yokoyama T, Okada H.
Abstract
A Corriedale ewe was confirmed as the first atypical scrapie case during an active surveillance program for transmissible spongiform encephalopathies in small ruminants in Japan. The animal was homozygous for the AF141RQ haplotype of PRNP. The animal showed clinical neurological signs possibly due to listeriosis before culling. Western blot analysis showed an unusual multiple banded pattern with a low-molecular fragment at ~7 kDa. Histopathology revealed suppurative meningoencephalitis caused by listeriosis in the brainstem. Fine granular to globular immunostaining of disease-associated prion proteins was mainly detected in the neuropil of the spinal tract of the trigeminal nerve and in the white matter of the spinocerebellar tract. Based on these results, this case was conclusively diagnosed as atypical scrapie with encephalitic listeriosis.
Epidemiol Infect. 2017 Jan;145(2):326-328. Epub 2016 Oct 18.
Goats with aspartic acid or serine at codon 146 of the PRNP gene remain scrapie-negative after lifetime exposure in affected herds in Cyprus.
Georgiadou S, Ortiz-Pelaez A, Simmons MM, Windl O, Dawson M, Neocleous P, Papasavva-Stylianou P.
Abstract
The results of the study reported here are part of an ongoing integrated research programme aimed at producing additional, robust, evidence on the genetic resistance to classical scrapie in goats, with particular reference to codon 146. The study targeted animals aged ⩾6 years, which were born and raised in infected herds and were being culled for management reasons. A total of 556 animals were tested, and all positive animals (n = 117) were of the susceptible NN genotype. A total of 246 goats heterozygous or homozygous for putatively resistant alleles (S146 and D146) were screened with no positive results. The outcome of this study supports the hypothesis that the D146 and S146 alleles could be used as the basis for a nationwide strategy for breeding for resistance in the Cypriot goat population.
Vet Res. 2016 Nov 8;47(1):112.
L-BSE experimentally transmitted to sheep presents as a unique disease phenotype.
Simmons MM, Chaplin MJ, Konold T, Casalone C, Beck KE, Thorne L, Everitt S, Floyd T, Clifford D, Spiropoulos J.
Abstract
Apart from prion protein genotype, the factors determining the host range and susceptiblity for specific transmissible spongiform encephalopathy agents remain unclear. It is known that bovine atypical L-BSE can transmit to a range of species including primates and humanised transgenic mice. It is important, therefore, that there is as broad an understanding as possible of how such isolates might present in food animal species and how robust they are on inter- and intra-species transmission to inform surveillance sytems and risk assessments. This paper demonstrates that L-BSE can be intracerebrally transmitted to sheep of several genotypes, with the exception of ARR/ARR animals. Positive animals mostly present with a cataplectic form of disease characterized by collapsing episodes and reduced muscle tone. PrP accumulation is confined to the nervous system, with the exception of one animal with lymphoreticular involvement. In Western blot there was maintenance of the low molecular mass and glycoform profile associated with L-BSE, irrespective of ovine host genotype, but there was a substantially higher N-terminal antibody signal relative to the core-specific antibody, which is similar to the ratio associated with classical scrapie. The disease phenotype was maintained on experimental subpassage, but with a shortened survival time indicative of an original species barrier and subsequent adaptation. Passive surveillance approaches would be unlikely to identify such cases as TSE suspects, but current statutory active screening methods would be capable of detecting such cases and classifying them as unusual and requiring further investigation if they were to occur in the field.
Environ Res. 2016 Nov;151:587-594. doi: 10.1016/j.envres.2016.08.031. Epub 2016 Sep 1.
An assessment of the long-term persistence of prion infectivity in aquatic environments.
Marín-Moreno A, Espinosa JC, Fernández-Borges N, Píquer J, Girones R, Andreoletti O, Torres JM.
Abstract
The environment plays a key role in horizontal transmission of prion diseases, since prions are extremely resistant to classical inactivation procedures. In prior work, we observed the high stability of bovine spongiform encephalopathy (BSE) infectivity when these prions were incubated in aqueous media such as phosphate-buffered saline (PBS) or wastewater for nearly nine months. As a continuation of this experiment, the same samples were maintained in PBS or wastewater for five additional years and residual BSE infectivity was assessed in bovine PrPC transgenic mice. Over this long time period (more than six years), BSE infectivity was reduced by three and one orders of magnitude in wastewater and PBS respectively. To rule out a possible agent specific effect, sheep scrapie prions were subjected to the same experimental protocol, using eight years as the experimental end-point. No significant reduction in scrapie infectivity was observed over the first nine months of wastewater incubation while PBS incubation for eight years only produced a two logarithmic unit reduction in infectivity. By contrast, the dynamics of PrPRes persistence was different, disappearing progressively over the first year. The long persistence of prion infectivity observed in this study for two different agents provides supporting evidence of the assumed high stability of these agents in aquatic environments and that environmental processes or conventional wastewater treatments with low retention times would have little impact on prion infectivity. These results could have great repercussions in terms of risk assessment and safety for animals and human populations.
Vet Res. 2016 Oct 6;47(1):99.
Genetic, histochemical and biochemical studies on goat TSE cases from Cyprus.
Niedermeyer S, Eiden M, Toumazos P, Papasavva-Stylianou P, Ioannou I, Sklaviadis T, Panagiotidis C, Langeveld J, Bossers A, Kuczius T, Kaatz M, Groschup MH, Fast C.
Abstract
Scrapie and bovine spongiform encephalopathy (BSE) are transmissible spongiform encephalopathies (TSE's) affecting sheep and goats. Susceptibility of goats to scrapie is influenced by polymorphisms of the prion protein gene (PRNP) of the host. Five polymorphisms are associated with reduced susceptibility to TSE's. In the study presented here caprine samples from a scrapie eradication program on Cyprus were genotyped and further characterized using BioRad TeSeE rapid test, histological, immunohistochemical and biochemical methods. In total 42 goats from 20 flocks were necropsied from which 25 goats showed a positive result in the rapid test, a spongiform encephalopathy and an accumulation of pathological prion protein (PrPSc) in the obex. PrPSc deposits were demonstrated in the placenta, peripheral nervous and lymphoreticular system. Two animals showed PrPSc-accumulations in peripheral tissues only. By discriminatory immunoblots a scrapie infection could be confirmed for all cases. Nevertheless, slight deviations in the glycosylation pattern might indicate the presence of different scrapie strains. Furthermore scrapie samples from goats in the current study demonstrated less long term resistance to proteinase K than ovine or caprine BSE control samples. Reduced scrapie susceptibility according to the PRNP genotype was demonstrated (Fishers Exact test, p < 0.05) for the goats with at least one polymorphism (p = 0.023) at the six codons examined and in particular for those with polymorphisms at codon 146 (p = 0.016). This work characterizes scrapie in goats having implications for breeding and surveillance strategies.
Vet Res. 2016 Sep 22;47(1):96.
Goat K222-PrPC polymorphic variant does not provide resistance to atypical scrapie in transgenic mice.
Aguilar-Calvo P, Espinosa JC, Andréoletti O, González L, Orge L, Juste R, Torres JM.
Abstract
Host prion (PrPC) genotype is a major determinant for the susceptibility to prion diseases. The Q/K222-PrPC polymorphic variant provides goats and mice with high resistance against classical scrapie and bovine spongiform encephalopathy (BSE); yet its effect against atypical scrapie is unknown. Here, transgenic mice expressing the goat wild-type (wt) or the K222-PrPC variant were intracerebrally inoculated with several natural cases of atypical scrapie from sheep and goat and their susceptibility to the prion disease was determined. Goat wt and K222-PrPC transgenic mice were 100% susceptible to all the atypical scrapie isolates, showing similar survival times and almost identical disease phenotypes. The capacity of the K222-PrPC variant to replicate specifically the atypical scrapie strain as efficiently as the goat wt PrPC, but not the classical scrapie or cattle-BSE as previously reported, further suggests the involvement of concrete areas of the host PrPC in the strain-dependent replication of prions.
Front Vet Sci. 2016 Aug 2;3:60. doi: 10.3389/fvets.2016.00060. eCollection 2016.
Abnormalities in Brainstem Auditory Evoked Potentials in Sheep with Transmissible Spongiform Encephalopathies and Lack of a Clear Pathological Relationship.
Konold T, Phelan LJ, Cawthraw S, Simmons MM, Chaplin MJ, González L.
Abstract
Scrapie is transmissible spongiform encephalopathy (TSE), which causes neurological signs in sheep, but confirmatory diagnosis is usually made postmortem on examination of the brain for TSE-associated markers like vacuolar changes and disease-associated prion protein (PrP(Sc)). The objective of this study was to evaluate whether testing of brainstem auditory evoked potentials (BAEPs) at two different sound levels could aid in the clinical diagnosis of TSEs in sheep naturally or experimentally infected with different TSE strains [classical and atypical scrapie and bovine spongiform encephalopathy (BSE)] and whether any BAEP abnormalities were associated with TSE-associated markers in the auditory pathways. BAEPs were recorded from 141 clinically healthy sheep of different breeds and ages that tested negative for TSEs on postmortem tests to establish a reference range and to allow comparison with 30 sheep clinically affected or exposed to classical scrapie (CS) without disease confirmation (test group 1) and 182 clinically affected sheep with disease confirmation (test group 2). Abnormal BAEPs were found in 7 sheep (23%) of group 1 and 42 sheep (23%) of group 2. The proportion of sheep with abnormalities did not appear to be influenced by TSE strain or PrP(Sc) gene polymorphisms. When the magnitude of TSE-associated markers in the auditory pathways was compared between a subset of 12 sheep with and 12 sheep without BAEP abnormalities in group 2, no significant differences in the total PrP(Sc) or vacuolation scores in the auditory pathways could be found. However, the data suggested that there was a difference in the PrP(Sc) scores depending on the TSE strain because PrP(Sc) scores were significantly higher in sheep with BAEP abnormalities infected with classical and L-type BSE, but not with CS. The results indicated that BAEPs may be abnormal in sheep infected with TSEs but the test is not specific for TSEs and that neither vacuolation nor PrP(Sc) accumulation appears to be responsible for the clinical abnormalities.
PLoS One. 2016 Mar 11;11(3):e0151440. doi: 10.1371/journal.pone.0151440. eCollection 2016. Minimum Effective Dose of Cattle and Sheep BSE for Oral Sheep Infection.
McGovern G, Martin S, Jeffrey M, Dexter G, Hawkins SA, Bellworthy SJ, Thurston L, Algar L, González L.
Abstract
The minimum dose required to cause infection of Romney and Suffolk sheep of the ARQ/ARQ or ARQ/ARR prion protein gene genotypes following oral inoculation with Romney or Suffolk a sheep Bovine spongiform encephalopathy (BSE)-derived or cattle BSE-derived agent was investigated using doses ranging from 0.0005g to 5g. ARQ/ARQ sheep which were methionine (M) / threonine (T) heterozygous or T/T homozygous at codon 112 of the Prnp gene, dosed ARQ/ARR sheep and undosed controls did not show any evidence of infection. Within groups of susceptible sheep, the minimum effective oral dose of BSE was found to be 0.05g, with higher attack rates following inoculation with the 5g dose. Surprisingly, this study found no effect of dose on survival time suggesting a possible lack of homogeneity within the inoculum. All clinical BSE cases showed PrPd accumulation in brain; however, following cattle BSE inoculation, LRS involvement within Romney recipients was found to be significantly lower than within the Suffolk sheep inoculated group which is in agreement with previous reports.
Vet Res. 2016 Jan 7;47:14. doi: 10.1186/s13567-015-0295-8.
Transmission of sheep-bovine spongiform encephalopathy to pigs.
Hedman C, Bolea R, Marín B, Cobrière F, Filali H, Vazquez F, Pitarch JL, Vargas A, Acín C, Moreno B, Pumarola M, Andreoletti O, Badiola JJ.
Abstract
Experimental transmission of the bovine spongiform encephalopathy (BSE) agent has been successfully reported in pigs inoculated via three simultaneous distinct routes (intracerebral, intraperitoneal and intravenous). Sheep derived BSE (Sh-BSE) is transmitted more efficiently than the original cattle-BSE isolate in a transgenic mouse model expressing porcine prion protein. However, the neuropathology and distribution of Sh-BSE in pigs as natural hosts, and susceptibility to this agent, is unknown. In the present study, seven pigs were intracerebrally inoculated with Sh-BSE prions. One pig was euthanized for analysis in the preclinical disease stage. The remaining six pigs developed neurological signs and histopathology revealed severe spongiform changes accompanied by astrogliosis and microgliosis throughout the central nervous system. Intracellular and neuropil-associated pathological prion protein (PrP(Sc)) deposition was consistently observed in different brain sections and corroborated by Western blot. PrP(Sc) was detected by immunohistochemistry and enzyme immunoassay in the following tissues in at least one animal: lymphoid tissues, peripheral nerves, gastrointestinal tract, skeletal muscle, adrenal gland and pancreas. PrP(Sc) deposition was revealed by immunohistochemistry alone in the retina, optic nerve and kidney. These results demonstrate the efficient transmission of Sh-BSE in pigs and show for the first time that in this species propagation of bovine PrP(Sc) in a wide range of peripheral tissues is possible. These results provide important insight into the distribution and detection of prions in non-ruminant animals.
Berl Munch Tierarztl Wochenschr. 2015 Nov-Dec;128(11-12):478-82.
Economic analysis of animal disease outbreaks--BSE and Bluetongue disease as examples.
Gethmann J, Probst C, Sauter-Louis C, Conraths FJ.
Abstract
Although there is a long tradition of research on animal disease control, economic evaluation of control measures is rather limited in veterinary medicine. This may, on the one hand, be due to the different types of costs and refunds and the different people and organizations bearing them, such as animal holders, county, region, state or European Union, but it may also be due to the fact that economic analyses are both complex and time consuming. Only recently attention has turned towards economic analysis in animal disease control. Examples include situations, when decisions between different control measures must be taken, especially if alternatives to culling or compulsory vaccination are under discussion. To determine an optimal combination of control measures (strategy), a cost-benefit analysis should be performed. It is not necessary to take decisions only based on the financial impact, but it becomes possible to take economic aspects into account. To this end, the costs caused by the animal disease and the adopted control measures must be assessed. This article presents a brief overview of the methodological approaches used to retrospectively analyse the economic impact of two particular relevant diseases in Germany in the last few years: Blue-tongue disease (BT) and Bovine Spongiform Encephalopathy (BSE).
PLoS One. 2015 Nov 20;10(11):e0143251. doi: 10.1371/journal.pone.0143251. eCollection 2015.
Comparative Susceptibility of Sheep of Different Origins, Breeds and PRNP Genotypes to Challenge with Bovine Spongiform Encephalopathy and Scrapie.
Houston F, Goldmann W, Foster J, González L, Jeffrey M, Hunter N.
Abstract
Sheep are natural hosts of the prion disease, scrapie. They are also susceptible to experimental challenge with various scrapie strains and with bovine spongiform encephalopathy (BSE), which affects cattle and has been accidentally transmitted to a range of other species, including man. Incidence and incubation period of clinical disease in sheep following inoculation is controlled by the PRNP gene, which has different alleles defined on the basis of polymorphisms, particularly at codons 136, 154 and 171, although other codons are associated with survival time, and the exact responses of the sheep may be influenced by other breed-related differences. Here we report the results of a long term single study of experimental scrapie and BSE susceptibility of sheep of Cheviot, Poll Dorset and Suffolk breeds, originating from New Zealand and of a wide range of susceptible and resistant PRNP genotypes. Responses were compared with those of sheep from a closed Cheviot flock of UK origin (Roslin Cheviot flock). The unusually long observation period (6-8 years for most, but up to 12 years for others) allows us to draw robust conclusions about rates of survival of animals previously regarded as resistant to infection, particularly PRNP heterozygotes, and is the most comprehensive such study reported to date. BSE inoculation by an intracerebral route produced disease in all genotype groups with differing incubation periods, although M112T and L141F polymorphisms seemed to give some protection. Scrapie isolate SSBP/1, which has the shortest incubation period in sheep with at least one VRQ PRNP allele, also produced disease following sub-cutaneous inoculation in ARQ/ARQ animals of New Zealand origin, but ARQ/ARQ sheep from the Roslin flock survived the challenge. Our results demonstrate that the links between PRNP genotype and clinical prion disease in sheep are much less secure than previously thought, and may break down when, for example, a different breed of sheep is moved into a new flock.
J Virol. 2015 Oct 28;90(2):805-12. doi: 10.1128/JVI.02316-15.
Prion Type-Dependent Deposition of PRNP Allelic Products in Heterozygous Sheep.
Langeveld JP, Jacobs JG, Hunter N, van Keulen LJ, Lantier F, van Zijderveld FG, Bossers A.
Abstract
Susceptibility or resistance to prion infection in humans and animals depends on single prion protein (PrP) amino acid substitutions in the host, but the agent's modulating role has not been well investigated. Compared to disease incubation times in wild-type homozygous ARQ/ARQ (where each triplet represents the amino acids at codons 136, 154, and 171, respectively) sheep, scrapie susceptibility is reduced to near resistance in ARR/ARR animals while it is strongly enhanced in VRQ/VRQ carriers. Heterozygous ARR/VRQ animals exhibit delayed incubation periods. In bovine spongiform encephalopathy (BSE) infection, the polymorphism effect is quite different although the ARR allotype remains the least susceptible. In this study, PrP allotype composition in protease-resistant prion protein (PrP(res)) from brain of heterozygous ARR/VRQ scrapie-infected sheep was compared with that of BSE-infected sheep with a similar genotype. A triplex Western blotting technique was used to estimate the two allotype PrP fractions in PrP(res) material from BSE-infected ARR/VRQ sheep. PrP(res) in BSE contained equimolar amounts of VRQ- and ARR-PrP, which contrasts with the excess (>95%) VRQ-PrP fraction found in PrP in scrapie. This is evidence that transmissible spongiform encephalopathy (TSE) agent properties alone, perhaps structural aspects of prions (such as PrP amino acid sequence variants and PrP conformational state), determine the polymorphic dependence of the PrP(res) accumulation process in prion formation as well as the disease-associated phenotypic expressions in the host.
IMPORTANCE:
Transmissible spongiform encephalopathies (TSEs) are fatal neurodegenerative and transmissible diseases caused by prions. Amino acid sequence variants of the prion protein (PrP) determine transmissibility in the hosts, as has been shown for classical scrapie in sheep. Each individual produces a separate PrP molecule from its two PrP gene copies. Heterozygous scrapie-infected sheep that produce two PrP variants associated with opposite scrapie susceptibilities (136V-PrP variant, high; 171R-PrP variant, very low) contain in their prion material over 95% of the 136V PrP variant. However, when these sheep are infected with prions from cattle (bovine spongiform encephalopathy [BSE]), both PrP variants occur in equal ratios. This shows that the infecting prion type determines the accumulating PrP variant ratio in the heterozygous host. While the host's PrP is considered a determining factor, these results emphasize that prion structure plays a role during host infection and that PrP variant involvement in prions of heterozygous carriers is a critical field for understanding prion formation.
Vet Res. 2015 Oct 28;46:126. doi: 10.1186/s13567-015-0269-x.
Dynamics of the natural transmission of bovine spongiform encephalopathy within an intensively managed sheep flock.
Jeffrey M, Witz JP, Martin S, Hawkins SA, Bellworthy SJ, Dexter GE, Thurston L, González L.
Abstract
Sheep are susceptible to the bovine spongiform encephalopathy (BSE) agent and in the UK they may have been exposed to BSE via contaminated meat and bone meal. An experimental sheep flock was established to determine whether ovine BSE could be naturally transmitted under conditions of intensive husbandry. The flock consisted of 113 sheep of different breeds and susceptible PRNP genotypes orally dosed with BSE, 159 sheep subsequently born to them and 125 unchallenged sentinel controls. BSE was confirmed in 104 (92%) orally dosed sheep and natural transmission was recorded for 14 of 79 (18%) lambs born to BSE infected dams, with rates varying according to PRNP genotype. The likelihood of natural BSE transmission was linked to stage of incubation period of the dam: the attack rate for lambs born within 100 days of the death of BSE infected dams was significantly higher (9/22, 41%) than for the rest (5/57, 9%). Within the group of ewes lambing close to death, those rearing infected progeny (n = 8, for 9/12 infected lambs) showed a significantly greater involvement of lymphoid tissues than those rearing non-infected offspring (n = 8, for 0/10 infected lambs). Horizontal transmission to the progeny of non-infected mothers was recorded only once (1/205, 0.5%). This low rate of lateral transmission was attributed, at least partly, to an almost complete absence of infected placentas. We conclude that, although BSE can be naturally transmitted through dam-lamb close contact, the infection in this study flock would not have persisted due to low-efficiency maternal and lateral transmissions.
Vet Microbiol. 2015 Dec 14;181(1-2):53-65. doi: 10.1016/j.vetmic.2015.07.015. Epub 2015 Jul 15.
Zoonotic risks from small ruminants.
Ganter M.
Abstract
Zoonoses are infections that spread naturally between species (sometimes by a vector) from animals to other animal species or to humans or from humans to animals. Most of the zoonoses diagnosed in sheep and goats are transmitted by close contact of man with these animals and are, more often, occupational diseases that principally affect breeders, veterinarians and/or slaughterhouse workers. Some other diseases have an airborne transmission and affect the population in the vicinity of sheep/goat farms. Due to the fact that small ruminants are almost the only remaining animals which are migrating in industrialised countries, there is a severe risk for transmitting the diseases. Some other zoonotic diseases are foodborne diseases, which are mainly transmitted from animals to humans and to other animal species by contaminated food and water. Within the last decade central Europe was threatened by some new infections, e.g., bluetongue disease and schmallenberg disease, which although not of zoonotic interest, are caused by pathogens transmitted by vectors. Causal agents of both diseases have found highly effective indigenous vectors. In the future, climate change may possibly modify conditions for the vectors and influence their distribution and competence. By this, other vector-borne zoonotic infections may propagate into former disease free countries. Changes in human behaviour in consummation and processing of food, in animal housing and management may also influence future risks for zoonosis. Monitoring, prevention and control measures are proposed to limit further epidemics and to enable the containment of outbreaks. Measures depend mainly on the damage evoked or anticipated by the disease, the local situation, and the epidemiology of the zoonoses, the presence of the infective agent in wild and other animals, as well as the resistance of the causal microorganisms in the environment and the possibility to breed sheep and goats which are resistant to specific infections. In this review, the clinical signs in animals and humans of the main sheep and goat zoonoses, as well as the transmission route and the control measures are reported. Brucellosis, chlamydophilosis, Q fever, Orf, Rift valley fever and Bovine Spongiform Encephalopathy are described in greater detail, in order to determine factors that contribute to the choice of the control strategies.
Bioinform Biol Insights. 2015 Sep 24;9(Suppl 4):1-10. doi: 10.4137/BBI.S29678. eCollection 2015.
Genetics of Prion Disease in Cattle.
Murdoch BM, Murdoch GK.
Abstract
Bovine spongiform encephalopathy (BSE) is a prion disease that is invariably fatal in cattle and has been implicated as a significant human health risk. As a transmissible disease of livestock, it has impacted food safety, production practices, global trade, and profitability. Genetic polymorphisms that alter the prion protein in humans and sheep are associated with transmissible spongiform encephalopathy susceptibility or resistance. In contrast, there is no strong evidence that nonsynonymous mutations in the bovine prion gene (PRNP) are associated with classical BSE (C-BSE) disease susceptibility, though two bovine PRNP insertion/deletion polymorphisms, in the putative region, are associated with susceptibility to C-BSE. However, these associations do not explain the full extent of BSE susceptibility, and loci outside of PRNP appear to be associated with disease incidence in some cattle populations. This article provides a review of the current state of genetic knowledge regarding prion diseases in cattle.
BMC Res Notes. 2015 Jul 24;8:312. doi: 10.1186/s13104-015-1260-3.
Further characterisation of transmissible spongiform encephalopathy phenotypes after inoculation of cattle with two temporally separated sources of sheep scrapie from Great Britain.
Konold T, Nonno R, Spiropoulos J, Chaplin MJ, Stack MJ, Hawkins SA, Cawthraw S, Wilesmith JW, Wells GA, Agrimi U, Di Bari MA, Andréoletti O, Espinosa JC, Aguilar-Calvo P, Torres JM.
Abstract
BACKGROUND:
The infectious agent responsible for the bovine spongiform encephalopathy (BSE) epidemic in Great Britain is a transmissible spongiform encephalopathy (TSE) strain with uniform properties but the origin of this strain remains unknown. Based on the hypothesis that classical BSE may have been caused by a TSE strain present in sheep, cattle were inoculated intracerebrally with two different pools of brains from scrapie-affected sheep sourced prior to and during the BSE epidemic to investigate resulting disease phenotypes and characterise their causal agents by transmission to rodents.
RESULTS:
As reported in 2006, intracerebral inoculation of cattle with pre-1975 and post-1990 scrapie brain pools produced two distinct disease phenotypes, which were unlike classical BSE. Subsequent to that report none of the remaining cattle, culled at 10 years post inoculation, developed a TSE. Retrospective Western immunoblot examination of the brains from TSE cases inoculated with the pre-1975 scrapie pool revealed a molecular profile similar to L-type BSE. The inoculation of transgenic mice expressing the bovine, ovine, porcine, murine or human prion protein gene and bank voles with brains from scrapie-affected cattle did not detect classical or atypical BSE strains but identified two previously characterised scrapie strains of sheep.
CONCLUSIONS:
Characterisation of the causal agents of disease resulting from exposure of cattle to naturally occurring scrapie agents sourced in Great Britain did not reveal evidence of classical or atypical BSE, but did identify two distinct previously recognised strains of scrapie. Although scrapie was still recognizable upon cattle passage there were irreconcilable discrepancies between the results of biological strain typing approaches and molecular profiling methods, suggesting that the latter may not be appropriate for the identification and differentiation of atypical, particularly L-type, BSE agents from cattle experimentally infected with a potential mixture of classical scrapie strains from sheep sources.
ILAR J. 2015;56(1):7-25. doi: 10.1093/ilar/ilv008.
The transmissible spongiform encephalopathies of livestock.
Greenlee JJ, Greenlee MH.
Abstract
Prion diseases or transmissible spongiform encephalopathies (TSEs) are fatal protein-misfolding neurodegenerative diseases. TSEs have been described in several species, including bovine spongiform encephalopathy (BSE) in cattle, scrapie in sheep and goats, chronic wasting disease (CWD) in cervids, transmissible mink encephalopathy (TME) in mink, and Kuru and Creutzfeldt-Jakob disease (CJD) in humans. These diseases are associated with the accumulation of a protease-resistant, disease-associated isoform of the prion protein (called PrP(Sc)) in the central nervous system and other tissues, depending on the host species. Typically, TSEs are acquired through exposure to infectious material, but inherited and spontaneous TSEs also occur. All TSEs share pathologic features and infectious mechanisms but have distinct differences in transmission and epidemiology due to host factors and strain differences encoded within the structure of the misfolded prion protein. The possibility that BSE can be transmitted to humans as the cause of variant Creutzfeldt-Jakob disease has brought attention to this family of diseases. This review is focused on the TSEs of livestock: bovine spongiform encephalopathy in cattle and scrapie in sheep and goats.
Front Mol Biosci. 2015 Mar 11;2:7. doi: 10.3389/fmolb.2015.00007. eCollection 2015.
Pyroglutamyl-N-terminal prion protein fragments in sheep brain following the development of transmissible spongiform encephalopathies.
Gielbert A, Thorne JK, Hope J.
Abstract
Protein misfolding, protein aggregation and disruption to cellular proteostasis are key processes in the propagation of disease and, in some progressive neurodegenerative diseases of the central nervous system, the misfolded protein can act as a self-replicating template or prion converting its normal isoform into a misfolded copy of itself. We have investigated the sheep transmissible spongiform encephalopathy, scrapie, and developed a multiple selected reaction monitoring (mSRM) mass spectrometry assay to quantify brain peptides representing the "ragged" N-terminus and the core of ovine prion protein (PrP(Sc)) by using Q-Tof mass spectrometry. This allowed us to identify pyroglutamylated N-terminal fragments of PrP(Sc) at residues 86, 95 and 101, and establish that these fragments were likely to be the result of in vivo processes. We found that the ratios of pyroglutamylated PrP(Sc) fragments were different in sheep of different breeds and geographical origin, and our expanded ovine PrP(Sc) assay was able to determine the ratio and allotypes of PrP accumulating in diseased brain of PrP heterozygous sheep; it also revealed significant differences between N-terminal amino acid profiles (N-TAAPs) in other types of ovine prion disease, CH1641 scrapie and ovine BSE. Variable rates of PrP misfolding, aggregation and degradation are the likely basis for phenotypic (or strain) differences in prion-affected animals and our mass spectrometry-based approach allows the simultaneous investigation of factors such as post-translational modification (pyroglutamyl formation), conformation (by N-TAAP analysis) and amino-acid polymorphisms (allotype ratio) which affect the kinetics of these proteostatic processes.
J Infect Dis. 2015 Aug 15;212(4):664-72. doi: 10.1093/infdis/jiv112. Epub 2015 Feb 26.
Effect of Q211 and K222 PRNP Polymorphic Variants in the Susceptibility of Goats to Oral Infection With Goat Bovine Spongiform Encephalopathy.
Aguilar-Calvo P, Fast C, Tauscher K, Espinosa JC, Groschup MH, Nadeem M, Goldmann W, Langeveld J, Bossers A, Andreoletti O, Torres JM.
Author information
Abstract
BACKGROUND:
The prion protein-encoding gene (PRNP) is one of the major determinants for scrapie occurrence in sheep and goats. However, its effect on bovine spongiform encephalopathy (BSE) transmission to goats is not clear.
METHODS:
Goats harboring wild-type, R/Q211 or Q/K222 PRNP genotypes were orally inoculated with a goat-BSE isolate to assess their relative susceptibility to BSE infection. Goats were killed at different time points during the incubation period and after the onset of clinical signs, and their brains as well as several peripheral tissues were analyzed for the accumulation of pathological prion protein (PrP(Sc)) and prion infectivity by mouse bioassay.
RESULTS:
R/Q211 goats displayed delayed clinical signs compared with wild-type goats. Deposits of PrP(Sc) were detected only in brain, whereas infectivity was present in peripheral tissues too. In contrast, none of the Q/K222 goats showed any evidence of clinical prion disease. No PrP(Sc) accumulation was observed in their brains or peripheral tissues, but very low infectivity was detected in some tissues very long after inoculation (44-45 months).
CONCLUSIONS:
These results demonstrate that transmission of goat BSE is genotype dependent, and they highlight the pivotal protective effect of the K222 PRNP variant in the oral susceptibility of goats to BSE.
PLoS One. 2015 May 6;10(5):e0125605. doi: 10.1371/journal.pone.0125605. eCollection 2015.
Reactions to ingroup and outgroup deviants: an experimental group paradigm for black sheep effect.
Rullo M, Presaghi F, Livi S.
Abstract
In the classic black sheep effect (BSE) an ingroup deviant member is usually evaluated more negatively than the corresponding outgroup deviant. This effect is usually obtained by using scenarios and asking people to imagine the situation as vividly as possible. The present study proposes a new method to investigate the BSE by considering the behavioral and physiological reactions to unfair behavior (aggressive game behavior) in a realistic experimental group-setting. The study involved 52 university students in a minimal group setting who performed a modified version of the competitive reaction time (CRT) task adapted to be played in groups of four people. The classic BSE was replicated for evaluation but not for the behavioral reactions (retaliate to aggression) to deviants. More interestingly, a negative relationship emerged in the ingroup deviant condition between the level of behavioral derogation and the systolic blood pressure level.
J Comp Pathol. 2015 Jan;152(1):28-40. doi: 10.1016/j.jcpa.2014.09.004. Epub 2014 Nov 27.
Influence of breed and genotype on the onset and distribution of infectivity and disease-associated prion protein in sheep following oral infection with the bovine spongiform encephalopathy agent.
McGovern G, Martin S, Jeffrey M, Bellworthy SJ, Spiropoulos J, Green R, Lockey R, Vickery CM, Thurston L, Dexter G, Hawkins SA, González L.
Abstract
The onset and distribution of infectivity and disease-specific prion protein (PrP(d)) accumulation was studied in Romney and Suffolk sheep of the ARQ/ARQ, ARQ/ARR and ARR/ARR prion protein gene (Prnp) genotypes (where A stands for alanine, R for arginine and Q for glutamine at codons 136, 154 and 171 of PrP), following experimental oral infection with cattle-derived bovine spongiform encephalopathy (BSE) agent. Groups of sheep were killed at regular intervals and a wide range of tissues taken for mouse bioassay or immunohistochemistry (IHC), or both. Bioassay results for infectivity were mostly coincident with those of PrP(d) detection by IHC both in terms of tissues and time post infection. Neither PrP(d) nor infectivity was detected in any tissues of BSE-dosed ARQ/ARR or ARR/ARR sheep or of undosed controls. Moreover, four ARQ/ARQ Suffolk sheep, which were methionine (M)/threonine heterozygous at codon 112 of the Prnp gene, did not show any biological or immunohistochemical evidence of infection, while those homozygous for methionine (MARQ/MARQ) did. In MARQ/MARQ sheep of both breeds, initial PrP(d) accumulation was identified in lymphoreticular system (LRS) tissues followed by the central nervous system (CNS) and enteric nervous system (ENS) and finally by the autonomic nervous system and peripheral nervous system and other organs. Detection of infectivity closely mimicked this sequence. No PrP(d) was observed in the ENS prior to its accumulation in the CNS, suggesting that ENS involvement occurred simultaneously to that of, or followed centrifugal spread from, the CNS. The distribution of PrP(d) within the ENS further suggested a progressive spread from the ileal plexus to other ENS segments via neuronal connections of the gut wall. Differences between the two breeds were noted in terms of involvement of LRS and ENS tissues, with Romney sheep showing a more delayed and less consistent PrP(d) accumulation than Suffolk sheep in such tissues. Whether this accounted for the slight delay (∼5 months) in the appearance of clinical signs in Romney sheep is debatable since by the last scheduled kill before animals reached clinical end point, both breeds showed widespread accumulation and similar magnitudes of PrP(d) accumulation in the brain.
Vet Rec. 2014 May 24;174(21):530. doi: 10.1136/vr.102255. Epub 2014 Apr 2.
The impact of the National Scrapie Plan on the PRNP genotype distribution of the British national flock, 20022012.
OrtizPelaez A, Thompson CE, Dawson M.
J Virol. 2014 Apr;88(8):45914. doi: 10.1128/JVI.0326413. Epub 2014 Jan 22.
Evidence of in utero transmission of classical scrapie in sheep.
Spiropoulos J, Hawkins SA, Simmons MM, Bellworthy SJ
Prion. 2014;8(4):296-305. doi: 10.4161/19336896.2014.983396.
Sheep prions with molecular properties intermediate between classical scrapie, BSE and CH1641-scrapie.
Langeveld JP, Jacobs JG, Erkens JH, Baron T, Andréoletti O, Yokoyama T, van Keulen LJ, van Zijderveld FG, Davidse A, Hope J, Tang Y, Bossers A.
Abstract
Efforts to differentiate bovine spongiform encephalopathy (BSE) from scrapie in prion infected sheep have resulted in effective methods to decide about the absence of BSE. In rare instances uncertainties remain due to assumptions that BSE, classical scrapie and CH1641-a rare scrapie variant-could occur as mixtures. In field samples including those from fallen stock, triplex Western blotting analyses of variations in the molecular properties of the proteinase K resistant part of the disease associated form of prion protein (PrP(res)) represents a powerful tool for quick discrimination purposes. In this study we examined 7 deviant ovine field cases of scrapie for some typical molecular aspects of PrP(res) found in CH1641 scrapie, classical scrapie and BSE. One case was most close to scrapie with respect to molecular mass of its non-glycosylated fraction and N-terminally located 12B2 epitope content. Two cases were unlike classical scrapie but too weak to differentiate between BSE or CH1641. The other 4 cases appeared intermediate between scrapie and CH1641 with a reduced molecular mass and 12B2 epitope content, together with the characteristic presence of a second PrP(res) population. The existence of these 2 PrP(res) populations was further confirmed through deglycosylation by PNGaseF. The findings indicate that discriminatory diagnosis between classical scrapie, CH1641 and BSE can remain inconclusive with current biochemical methods. Whether such intermediate cases represent mixtures of TSE strains should be further investigated e.g. in bioassays with rodent lines that are varying in their susceptibility or other techniques suitable for strain typing.
Nat Commun. 2014 Dec 16;5:5821. doi: 10.1038/ncomms6821.
Evidence for zoonotic potential of ovine scrapie prions.
Cassard H, Torres JM, Lacroux C, Douet JY, Benestad SL, Lantier F, Lugan S, Lantier I, Costes P, Aron N, Reine F, Herzog L, Espinosa JC, Beringue V, Andréoletti O.
Abstract
Although Bovine Spongiform Encephalopathy (BSE) is the cause of variant Creutzfeldt Jakob disease (vCJD) in humans, the zoonotic potential of scrapie prions remains unknown. Mice genetically engineered to overexpress the human prion protein (tgHu) have emerged as highly relevant models for gauging the capacity of prions to transmit to humans. These models can propagate human prions without any apparent transmission barrier and have been used used to confirm the zoonotic ability of BSE. Here we show that a panel of sheep scrapie prions transmit to several tgHu mice models with an efficiency comparable to that of cattle BSE. The serial transmission of different scrapie isolates in these mice led to the propagation of prions that are phenotypically identical to those causing sporadic CJD (sCJD) in humans. These results demonstrate that scrapie prions have a zoonotic potential and raise new questions about the possible link between animal and human prions.
Prion. 2014;8(4):286-95. doi: 10.4161/pri.29237. Epub 2014 Nov 1.
Variant CJD. 18 years of research and surveillance.
Diack AB, Head MW, McCutcheon S, Boyle A, Knight R, Ironside JW, Manson JC, Will RG.
Abstract
It is now 18 years since the first identification of a case of vCJD in the UK. Since that time, there has been much speculation over how vCJD might impact human health. To date there have been 177 case reports in the UK and a further 51 cases worldwide in 11 different countries. Since establishing that BSE and vCJD are of the same strain of agent, we have also shown that there is broad similarity between UK and non-UK vCJD cases on first passage to mice. Transgenic mouse studies have indicated that all codon 129 genotypes are susceptible to vCJD and that genotype may influence whether disease appears in a clinical or asymptomatic form, supported by the appearance of the first case of potential asymptomatic vCJD infection in a PRNP 129MV patient. Following evidence of blood transfusion as a route of transmission, we have ascertained that all blood components and leucoreduced blood in a sheep model of vCJD have the ability to transmit disease. Importantly, we recently established that a PRNP 129MV patient blood recipient with an asymptomatic infection and limited PrP(Sc) deposition in the spleen could readily transmit disease into mice, demonstrating the potential for peripheral infection in the absence of clinical disease. This, along with the recent appendix survey which identified 16 positive appendices in a study of 32,441 cases, underlines the importance of continued CJD surveillance and maintaining control measures already in place to protect human health.
Prev Vet Med. 2014 Nov 1;117(1):242-50. doi: 10.1016/j.prevetmed.2014.07.015. Epub 2014 Aug 10.
The evolution of the prevalence of classical scrapie in sheep in Great Britain using surveillance data between 2005 and 2012.
Arnold M, Ortiz-Pelaez A.
Abstract
After the decline of the Bovine Spongiform Encephalopathy (BSE) epidemic in Great Britain (GB), scrapie remains the most prevalent animal Transmissible Spongiform Encephalopathy (TSE) present in GB. A number of control measures have been implemented for classical scrapie, and since 2005 there has been a large reduction in the number of observed cases. The objective of this study is to estimate two measures of disease frequency using up to date surveillance data collected during and after the implementation of different control measures established since 2004, and breeding for resistance schemes that ran from 2001 until 2009. This would enable an assessment of the effectiveness of both the breeding for resistance programme and the compulsory eradication measures in reducing the prevalence of scrapie in GB. Evaluation of the sensitivity of the rapid post-mortem test for scrapie indicated that it detected scrapie in the last 25% of the incubation period. A back-calculation model was developed to estimate the prevalence of infection at animal and flock-level. The results of the model indicated a mean drop of infection prevalence of 31% each year, leading to a 90% drop in infection prevalence between 2005, with an estimate of 5737 infected sheep in GB in 2012. The risks of classical scrapie infection in animals with genotypes of National Scrapie Plan Types I-IV (all other genotypes), relative to Type V (all genotypes containing V136 R154 Q171 and not A136 R154 R171), were estimated to be: 0, 0.0008, 0.07, and 0.21 respectively. The model estimated a very low rate of reporting of clinical suspects and a large decline from 2007 of the probability of a sheep being reported as a clinical suspect. The model also estimated that the expected number of sheep holdings with classical scrapie in 2012 was 215 (95% confidence interval: 33-437), out of a total of approximately 72,000 sheep holdings in GB. Model estimates indicate that the prevalence in 2012 has dropped to 10% of that in 2005, showing the effectiveness of the control measures. It also shows a bias in the destination of infected animals, with the majority of infected animals being detected in the fallen stock surveillance stream, and an extremely low proportion of animals detected as clinical suspects; this is very important in terms of the design of surveillance schemes for classical scrapie.
J Clin Microbiol. 2014 Nov;52(11):3863-8. doi: 10.1128/JCM.01693-14. Epub 2014 Aug 20.
Highly sensitive detection of small ruminant bovine spongiform encephalopathy within transmissible spongiform encephalopathy mixes by serial protein misfolding cyclic amplification.
Gough KC, Bishop K, Maddison BC.
Abstract
It is assumed that sheep and goats consumed the same bovine spongiform encephalopathy (BSE)-contaminated meat and bone meal that was fed to cattle and precipitated the BSE epidemic in the United Kingdom that peaked more than 20 years ago. Despite intensive surveillance for cases of BSE within the small ruminant populations of the United Kingdom and European Union, no instances of BSE have been detected in sheep, and in only two instances has BSE been discovered in goats. If BSE is present within the small ruminant populations, it may be at subclinical levels, may manifest as scrapie, or may be masked by coinfection with scrapie. To determine whether BSE is potentially circulating at low levels within the European small ruminant populations, highly sensitive assays that can specifically detect BSE, even within the presence of scrapie prion protein, are required. Here, we present a novel assay based on the specific amplification of BSE PrP(Sc) using the serial protein misfolding cyclic amplification assay (sPMCA), which specifically amplified small amounts of ovine and caprine BSE agent which had been mixed into a range of scrapie-positive brain homogenates. We detected the BSE prion protein within a large excess of classical, atypical, and CH1641 scrapie isolates. In a blind trial, this sPMCA-based assay specifically amplified BSE PrP(Sc) within brain mixes with 100% specificity and 97% sensitivity when BSE agent was diluted into scrapie-infected brain homogenates at 1% (vol/vol).
Emerg Infect Dis. 2012 Oct;18(10):15749. doi: 10.3201/eid1810.120792.
Constant transmission properties of variant creutzfeldtjakob disease in 5 countries.
Diack AB, Ritchie D, Bishop M, Pinion V, Brandel JP, Haik S, Tagliavini F, Van Duijn C, Belay ED, Gambetti P, Schonberger LB, Piccardo P, Will RG, Manson JC.
Abstract:
Variant CreutzfeldtJakob disease (vCJD) has been reported in 12 countries. We hypothesized that a common strain of agent is responsible for all vCJD cases, regardless of geographic origin. To test this hypothesis, we inoculated straintyping panels of wildtype mice with brain material from human vCJD casepatients from France, the Netherlands, Italy, and the United States. Mice were assessed for clinical disease, neuropathologic changes, and glycoform profile; results were compared with those for 2 reference vCJD cases from the United Kingdom. Transmission to mice occurred from each sample tested, and data were similar between nonUK and UK cases, with the exception of the ranking of mean clinical incubation times of mouse lines. These findings support the hypothesis that a single strain of infectious agent is responsible for all vCJD infections. However, differences in incubation times require further subpassage in mice to establish any true differences in strain properties between cases.
PLoS One. 2009 Jul 28;4(7):e6175.
Evaluation of the possible transmission of BSE and scrapie to gilthead sea bream (Sparus aurata).
Salta E, Panagiotidis C, Teliousis K, Petrakis S, Eleftheriadis E, Arapoglou F, Grigoriadis N, Nicolaou A, Kaldrymidou E, Krey G, Sklaviadis T.
Abstract:
In transmissible spongiform encephalopathies (TSEs), a group of fatal neurodegenerative disorders affecting many species, the key event in disease pathogenesis is the accumulation of an abnormal conformational isoform (PrP(Sc)) of the hostencoded cellular prion protein (PrP(C)). While the precise mechanism of the PrP(C) to PrP(Sc) conversion is not understood, it is clear that host PrP(C) expression is a prerequisite for effective infectious prion propagation. Although there have been many studies on TSEs in mammalian species, little is known about TSE pathogenesis in fish. Here we show that while gilthead sea bream (Sparus aurata) orally challenged with brain homogenates prepared either from a BSE infected cow or from scrapie infected sheep developed no clinical prion disease, the brains of TSEfed fish sampled two years after challenge did show signs of neurodegeneration and accumulation of deposits that reacted positively with antibodies raised against sea bream PrP. The control groups, fed with brains from uninfected animals, showed no such signs. Remarkably, the deposits developed much more rapidly and extensively in fish inoculated with BSEinfected material than in the ones challenged with the scrapieinfected brain homogenate, with numerous deposits being proteinase Kresistant. These plaquelike aggregates exhibited congophilia and birefringence in polarized light, consistent with an amyloidlike component. The neurodegeneration and abnormal deposition in the brains of fish challenged with prion, especially BSE, raises concerns about the potential risk to public health. As fish aquaculture is an economically important industry providing high protein nutrition for humans and other mammalian species, the prospect of farmed fish being contaminated with infectious mammalian PrP(Sc), or of a prion disease developing in farmed fish is alarming and requires further evaluation.

GOAT-TSE-FREE
Scrapie ongevoelige geiten in Nederland:
zoektocht, behoud, en vermeerderen gezond erfelijk materiaal
Wanneer er een scrapie-infectie optreedt in een schapen- of geitenbedrijf, is de regelgeving zodanig dat bij geiten de hele kudde moet worden geruimd, bij schapen slechts de gevoelige dieren, de zogenaamde VRQ en ARQ dieren. Sinds hiernaar onderzoek wordt uitgevoerd bij geiten, blijken ook onder geiten dragers te zijn van een scrapieongevoeligheidsgen. Om hiermee te fokken in Nederland, zullen de dieren eerst moeten worden geïdentificeerd onder de beschikbare populatie, vervolgens zullen de dragers van dit gen moeten worden geïsoleerd en vermeerderd, en zullen die dieren zoveel mogelijk geschikt moeten zijn voor wat betreft eigenschappen die voor een gezonde productiesector van belang zijn.
Het project GOAT-TSE-FREE is daartoe in Europees verband goedgekeurd (EMIDA-ERA net organisatie), en door het Nederlands ministerie EL&I financieel gesteund. Zeven landen doen hieraan mee project (NL, GR, IT, SP, FR, UK, GE), waarbij wat betreft het betrekken van de sector ieder land haar eigen invulling kan geven en dit zal vastleggen in een nationaal werkdocument.
De sector wordt hierbij aangemoedigd en uitgenodigd mee te werken. Het zoeken naar dragers zal via bloedanalyses worden uitgevoerd in samenwerking met het WBVR en GD. Enige uitgebreidere informatie over dit project wordt in onderstaande samenvatting beschreven. Komende tijd zal allereerst een plan moeten worden opgesteld voor de komende drie jaar tussen WBVR, GD en vertegenwoordigers uit de sector.
Jan Langeveld, WBVR, Lelystad
Piet Vellema, GD, Deventer
GOAT-TSE-FREE
scrapie ongevoelige geiten in Nederland:
zoektocht, behoud, en vermeerderen gezond erfelijk materiaal
Wanneer er een scrapieinfectie optreedt op een schapen- of geitenbedrijf, is de regelgeving zodanig dat bij geiten de hele kudde moet worden geruimd, bij schapen slechts de gevoelige dieren, de zogenaamde VRQ- en ARQ-dieren. Omdat op grote schaal sinds 2000, maar op kleine schaal al eerder, bij schapen er genetische ongevoeligheid (‘resistentie’) is ingefokt, is klassieke scrapie in Nederland thans vrijwel verdwenen, en zijn ruimingen bij positieve bedrijven beperkt gebleven tot die dieren welke de gevoeligheidseigenschap (allel voor gevoeligheid) bezaten. Nederland loopt hierbij trouwens voorop, terwijl in landen zoals Frankrijk en Engeland lokaal ook is gebleken dat deze aanpak effectief is.
Scrapie bij geiten wordt slechts zelden in Nederland aangetroffen, eenmaal is het in 2000 voorgekomen. Deze uitbraak was op een kinderboerderij met schapen en geiten. Er waren vijf van de ongeveer tien geiten positief. De schapen op hetzelfde bedrijf waren allen negatief. De bron van deze besmetting is niet verklaard, en het was opvallend dat de schapen niet besmet waren hoewel dezelfde vorm van scrapie – klassieke scrapie - bij beide kleine herkauwers kan voorkomen, en beide diersoorten een zelfde soort spreiding vertonen (van dier naar dier vooral via nageboorte en in mindere mate via melk). Een spontane ontwikkeling van deze vorm van de ziekte wordt niet aangenomen.
Bij producerende geitenbedrijven kan een scrapiegeval nare gevolgen hebben in Nederland, want de bedrijven tellen veelal meer dan 500 dieren welke dan allen geruimd worden. In Europa is sinds 2005 gezocht naar de eventuele aanwezigheid van resistentieallelen in kuddes waar scrapie werd gediagnosticeerd. Inderdaad, twee varianten zijn gevonden namelijk op codons 222 en 146 (codons van het prioneiwit = PrP).
[1]
Eiwitten zijn opgebouwd uit aminozuren, waarvan er 20 verschillende bestaan. De 20 aminozuren worden met een letter aangeduid: A, C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W, Y. Die aminozuren zitten achterelkaar vastgeknoopt. De positie in het eiwit wordt aangeduid als “codon”nummer. Eiwitten verschillen van elkaar in aantal en volgorde der aminozuren. PrP of prioneiwit is een eiwit dat bij schapen en geiten uit 253 aminozuren is opgebouwd, waarbij nummering loopt van 1 tot 250. Erfelijke varianten hierin worden polymorfismen genoemd, waarbij een bepaald aminozuur kan zijn vervangen door een van de 19 andere. Bij schapen levert een variant op plaats 171 (171R, ofwel de zogenaamde ARR dieren) een hoge ongevoeligheid voor scrapie en BSE op. Bij geiten bestaat deze variant niet.
Variant op codon 222 blijkt bescherming te geven als 222K, en op codon 146 in twee vormen namelijk 146S en 146D. De twee 146-varianten komen vrijwel alleen voor op Cyprus, waar scrapie-uitbraken onder geiten een groot probleem vormen. De 222K-variant komt daar niet voor maar juist wel in de andere landen, inclusief Nederland. Voortschrijdend experimenteel onderzoek in geiten met diverse andere allelvarianten inclusief het meest algemene type (wilde type) laat zien dat ook onder experimentele omstandigheden deze 222K-variant een hoge mate van ongevoeligheid oplevert vergelijkbaar of beter dan 171R bij schapen (bij opzettelijke besmetting via mond of hersenen met klassieke scrapie of BSE) (zie figuur hieronder). Bovendien komt een atypische vorm van scrapie -zoals bekend bij schapen- ook bij geiten voor, maar dit is bij geiten alleen aangetroffen als er een 154H-codon aanwezig is. Over dit voorafgaande en thans in afronding zijnde onderzoek GoatBSE bestaat een website
www.goatbse.eu.
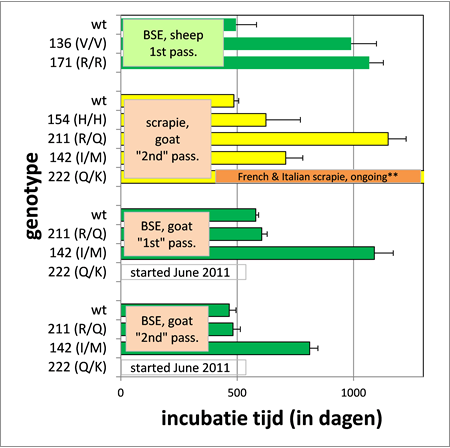 Intracerebrale besmettingen met runder BSE uit NL en geitenscrapie uit FR in geiten met verschillende allelen (allen heterozygoot waarbij het wildtype een van de allelen vormt, behalve de homozygote 154H/H dieren). De incubatietijden in geiten worden vergeleken met vergelijkbare BSE-besmettingen in schapen volgens Houston et al. 2003 (Prion diseases: BSE in sheep bred for resistance to infection. Nature 423, 498). Drie tot vijf geiten per testgroep. Bij “2nd pass.” werd BSE uit experimenteel besmette geiten doorgeënt in andere geiten, de meest effectieve manier en het meest krachtige entmateriaal om resistentie te testen.
Intracerebrale besmettingen met runder BSE uit NL en geitenscrapie uit FR in geiten met verschillende allelen (allen heterozygoot waarbij het wildtype een van de allelen vormt, behalve de homozygote 154H/H dieren). De incubatietijden in geiten worden vergeleken met vergelijkbare BSE-besmettingen in schapen volgens Houston et al. 2003 (Prion diseases: BSE in sheep bred for resistance to infection. Nature 423, 498). Drie tot vijf geiten per testgroep. Bij “2nd pass.” werd BSE uit experimenteel besmette geiten doorgeënt in andere geiten, de meest effectieve manier en het meest krachtige entmateriaal om resistentie te testen.
De frequentie van het 222K-allel is echter laag, in Nederland 2.8% (andere varianten varieren: 73% wildtype of 127G,142I,154R,211R,222Q, 6% 127S, 15% 142M, 0.4% 154H, 3.2% 211Q). Om dragers ervan te vinden en daarmee een fokprogramma op te zetten en zodoende een hogere mate van scrapieongevoeligheid op te bouwen onder productiedieren, zullen levende dragers gezocht moeten worden. Gezien de lage frequentie, is het belangrijk zoveel mogelijk bloedlijnen te onderzoeken. Tegelijkertijd zal rekening gehouden moeten worden met productie-eigenschappen en vrijheid van ziekte.
Europese situatie
Dit project is een Europa-breed project (NL, GR, IT, SP, FR, UK, DU, CYP), waarbij wat betreft het betrekken van de sector ieder land haar eigen invulling kan geven. In andere landen varieert het 222K-allelpercentage als volgt: 0.9 UK, 6.3 FR, 7.6 IT, 0 SP (behalve Alpine ras: 2.6-5.2), 4.4-17.7 IT, en 5.7 GR. Het 146S- en D-allel komen in de UK alleen voor onder vleesrassen (24%), en in Griekenland en Cyprus (resp. 3 en 7%). In Cyprus loopt een door de EU gesteund programma om deze 146S- en 146D-allelen in te fokken, en experimenteel te onderzoeken op scrapie-ongevoeligheid. Ten dienste van het project zal aan de start in ieder land een nationaal werkdocument worden opgesteld met de sector om invulling te geven aan dit project, aangepast aan de nationale situatie.
Uitvoerende partners in Nederland:
- Wageningen Bioveterinary Research, Lelystad
- Royal GD, Deventer
Dierziekteinformatie op de website van GD wordt voortdurend aangepast. De meest actuele versie van dit dierziektedossier vindt u dus altijd online.