- Home
- Dierziektes
- Rift-valley-fever
Rift valley fever
Rift valley fever (RVF) is een acuut verlopende virusinfectie, die verantwoordelijk is voor een acuut leverfalen, wat gepaard gaat met een heftige haemorrhagische enteritis. Meest opvallende kenmerken zijn een sterk verhoogde uitval bij de jonge dieren (lammeren en kalveren) en een massaal optreden van abortus bij oudere (drachtige) dieren. RVF is een meldingsplichtige ziekte volgens artikel 15 van de Gezondheids- en Welzijnswet voor Dieren. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA.
Veterinair kennisdossier Rift valley fever
- Verschijnselen
- Diagnose
- Prevalentie
- Aanpak besmette bedrijven
- Preventie
- Regelgeving
- Websites en literatuur
- Bijlage 1: Epidemiologie
- Bijlage 2: Promed
- Bijlage 3: Update 2012
De kiem
Het oorzakelijke virus van RVF is een arbo-virus (RNA-virus), behorend tot het genus Phlebovirus (P) en de virusfamilie Buyaviridae (B). De 5 genera die tot deze grote virusfamilie (>300 virussen) behoren zijn: Orthobunyavirus (O), Phlebovirus (P), Hantavirus (H), Nairovirus (N) en Tospovirus (T). Verschillende familieleden van B zijn verantwoordelijk voor vaak fataal verlopende septicaemische koorts: Rift Valey Fever-virus (RVFV) veroorzaakt door P-virus, Crimean-Congo haemorrhagische koorts (N-virus), Hantaan, Sin Nombre en gerelateerde aandoeningen (H-virus). Recentelijk (eind jaren 90’) is Garissa geïdentificeerd als te zijn veroorzaakt door Ngari-virus (O-virus).
Gevoelige diersoorten
RVF is vooral een aandoening die voorkomt bij kleine herkauwers (schapen, geiten) en runderen. Europese runderen zijn dan nog weer gevoeliger dan inheems Afrikaanse rassen. Andere diersoorten zijn relatief ongevoelig; paarden ontwikkelen na infectie wel antilichamen (in afwezigheid van kliniek), evenals kameelachtigen. Varkens kunnen ook wel geïnfecteerd worden, maar vertonen ook geen kliniek. Vogels hebben een natuurlijke weerstand tegen de infectie. Het reservoir voor het virus zijn geïnfecteerde muggen, die het virus geslachtelijk kunnen overdragen. Over het bestaan van andere reservoirs (knaagdieren) is niets bekend, daarnaast is niet goed duidelijk wat de rol van in het wild levende dieren is en dit dient nader uitgezocht te worden (Rostal et al., 2017).
Volksgezondheid
RVF is een zoönose. De overdracht (vector) van RVF gaat normaal gesproken via steken van geïnfecteerde muggen (mosquitos). Deze muggensoort is gelijk ook het reservoir van het virus. Bij uitzondering is melding gemaakt van overdracht naar mensen via geïnfecteerd weefsel en via aerogene transmissie en in theorie zouden teken ook nog kunnen, echter dit speelt in de verspreiding maar een beperkte rol. Vooral veehouders, dierenartsen, mensen in slachthuizen, handelaren, maar ook specialistische teams die betrokken zijn bij bijvoorbeeld een ontruiming, vormen een duidelijke risicogroep. Een bewezen infectieroute, die van minder belang wordt geacht, is het drinken van rauwe melk van geïnfecteerde dieren.
Overleving
Het reservoir voor het virus zijn dus geïnfecteerde muggen, die het virus geslachtelijk kunnen overdragen. Over het bestaan van andere reservoirs (knaagdieren) is niets bekend, evenals overleving in het wild levende dieren.
Desinfectie/preventie
Van het gebruik van anti-ectoparasita, bij voorkeur met een larvicide werking, gaat een preventieve werking uit.
Verschijnselen van Rift valley fever
De belangrijkste symptomen bij herkauwers zijn het (plotseling) optreden van hoge koorts en een ernstige algemeen ziek zijn (niet eten en zwakte), (bloederige) diarree en een verhoogde uitval bij jonge dieren (< 6 maanden). Bij de oudere (drachtige dieren) wordt vooral een abortusstorm (tot bijna 100%) waargenomen. Bij de mens worden in eerste instantie vooral griepachtige verschijnselen gezien.
Klinische verschijnselen per diersoort
De belangrijkste symptomen bij schapen zijn het (plotseling) optreden van hoge koorts, een ernstige algemeen ziek zijn (door vooral ernstig leverfalen) en (bloederige) diarree. Dit gaat op bedrijfsniveau gepaard met een sterk verhoogde uitval bij vooral jonge geiten en lammeren (tot 40% van de geïnfecteerde dieren). Bij oudere lammeren en volwassen schapen kan men naast koorts (40-41˚C) wisselende symptomen als braken, onzekere gang, diarree en hyperemische slijmvliezen aantreffen. Sterfte kan na 1-4 dagen optreden, maar is in de regel niet groter dan 10-30%. De sterfte kan overigens snel oplopen bij een achteruitgang van de algemene gezondheid (secundaire infecties). Bij drachtige ooien treedt massaal abortus op (95-100%) en komt een hoog percentage retentio secundinarum voor. Typisch hierbij zijn de degeneratieve veranderingen in de placenta, maar dit is moeilijk te diagnosticeren. Er zijn duidelijke verschillen in gevoeligheid tussen de verschillende schapenrassen beschreven.
Bij geiten zou de ziekte iets minder dramatisch verlopen.
Bij runderen is een (sterke) toename van abortus (80-100%) en/of een gestoorde vruchtbaarheid het belangrijkste symptoom na een RVF-infectie. Andere symptomen zijn koorts, speekselen, stinkende diarree en een verminderde melkproductie. Bij kalveren worden koorts, een sterk geforceerde ademhaling en sterfte waargenomen.
Symptomen bij de mens bestaan uit met koorts gepaard gaande griepverschijnselen (spierpijn, hoofdpijn, verhoogde druk op de oogkassen (retro-orbitale pijnen)). In de regel treedt na 4-7 dagen herstel op.
In een heel beperkt aantal gevallen treden (ernstige) complicaties op, zoals (2-4 dagen na het beëindigen van de koortsfase) septische koorts (met geelzucht, verkleuringen en bloedingen in de huid, en braken met bloedbijmenging). Dit stadium wordt veelal gezien voorafgaande aan een fataal verlopende complicatie. Een andere complicatie is meningo-encephalitis (5-15 dagen na het begin van de koortsfase), hierbij horen verschijnselen als desoriëntatie, hallucinatie en vertigo (draaiduizeligheid), wat uiteindelijk resulteert in coma en sterfte. De derde complicatie betreft aantasting (verkleuring en exsudaatvorming) van de retina (oog) en daaraan gekoppeld een sterk gestoorde visus. Dit begint ongeveer 15 dagen na het begin van de koortsfase en kan lange tijd blijven bestaan, dan wel tot blindheid leiden.
Morbiditeit/Mortaliteit
Schapen: De morbiditeit bij jonge dieren (< 1 maand) is hoog (tot 80%) met ook een hoge mortaliteit. Bij oudere lammeren en volwassen schapen is het verloop minder dramatisch met een mortaliteit van 10-30%.
Bij geiten verloopt de ziekte ook iets minder dramatisch.
Runderen: de morbiditeit bij kalveren kan oplopen tot 80%, de mortaliteit kan daarbij oplopen tot 70%. Bij volwassenen dieren is de mortaliteit laag (5-10%).
Er zijn een aantal waarnemingen die ons alert moeten maken op een mogelijke introductie van RVF. Samengevat;
- Hele hoge percentages abortus (90-100%) bij met name schapen en rundvee (minder bij geiten);
- Een erg hoge mortaliteit bij lammeren en kalveren met een leeftijd tot 7 dagen; afnemend met toenemende leeftijd;
- Uitgebreide veranderingen in de lever (focale necrose);
- Associatie met een regenperiode en de aanwezigheid van (veel) bijtende muggen/teken;
- Een mogelijke introductie vanuit Afrika of het Middellandse Zeegebied;
- Koortspieken bij mensen en dan speciaal in het geval van veel contact met vee, met een enkele complicatie in de vorm van encefalitis, retinitis met blindheid, of een dodelijk verlopende sepsis.
Uitscheiding van de kiem
In Afrika zijn 23 muggenspecies (behorende tot de genera Aedes, Culex, Anopheles, Eretmapodites en Masonia) gerelateerd aan de overdracht van RVFV. Verschillende RVFV-stammen zijn geïsoleerd uit in het wild gevangen muggen, alsook bij Culicoides, Simuli en teken (Rhipicephalus). Echter (zo wordt in de literatuur terecht opgemerkt) kan de transmissie in bepaalde gevallen ook via de lucht (aerosol) verlopen. In de literatuur worden de perioden na perioden van ongebruikelijk heftige regenval en/of perioden waarin dammen worden gebouwd als belangrijke factor genoemd voor het optreden van RVF. Bekend zijn onder andere het optreden van RVF in 1997/’98 na de overstromingen door El Niño in de hoorn van Afrika en na de overstroming van de Aswan en Diama in Egypte (1977). De aanwezigheid van al dat water is van belang voor het snel kunnen vermeerderen van de insecten. Men probeert nu op basis van gemeten neerslag, de vegetatie-index en radarinformatie over regen, RVF te voorspellen voor de komende 5 maanden.
Differentiaaldiagnose
Voor de differentiaaldiagnose komen bij jonge dieren aandoeningen in aanmerkingen die gepaard gaan met een hoge koorts en een hoge mortaliteit:
- Salmonella dublin, (in-)direct contact
- BVD-MD (idem)
- BTV (vooral overdracht door knutten (Culicoïdes spp.)
- MKZ (speekselen) (als S. dublin)
- BCK (OHV2- virus, transmissie via schapen)
Voor de differentiaaldiagnose komen bij oudere dieren aandoeningen in aanmerking die gepaard gaan met massaal verwerpen:
- Brucella abortus (in-) direct contact
- BVD (idem)
- Salmonella dublin (idem)
- Q-fever (speciaal bij geiten) (aerogeen)
- Neospora canium (hond eindgasthee)
Diagnose van Rift valley fever
Pathologie
Postmortale bevindingen
Heel typisch voor de pathologie is een focale necrose van de lever. Aanvankelijk hebben de laesies een diameter van 1-2 mm en zijn deze grijs van kleur, later zijn de “spots” meer bleek tot geel en verliest de lever zijn hepatogene structuur. De lever is bros, met onregelmatige verstoppingen en kan een gevlekte bruingelige kleur aannemen. Andere bevindingen zijn het optreden van subcutane en viscerale bloedinkjes, haemorrhagische enteritis en abomasitis, gegeneraliseerde lymfadenopathie en zelden bloedingen in het peritoneum. Het meest typisch zijn de leververanderingen, deze zijn bij iets oudere en volwassen schapen, runderen en geiten echter allemaal wat minder uitgesproken.
Microscopisch is een bijna complete destructie van de lobuli te vinden tot focale necrose van delen van de individuele lobuli. Deze bevindingen worden beschouwd als pathognomisch (zeer specifiek, bewijzend) voor RVF.
Isolatie van de kiem
Er zijn voldoende technieken beschikbaar om de diagnose RVF te bevestigen, in de eerste plaats histo-pathologie, van met name de lever. Hierbij dient wel rekening te worden gehouden met de diersoort en de leeftijd van het dier. Daarna zijn verschillende technieken beschikbaar om het virus te isoleren en te identificeren, dan wel is er de mogelijkheid om op basis van een RVFV-specifieke IgM en/of IgG en/of een 4-voudige sero-conversie de diagnose te bevestigen.
Serologie
Bloedonderzoek vertoont in alle gevallen een leocoponie (max. 3-4 dagen na infectie) en leucoponie in een later stadium, gepaard gaande met ernstige afwijkingen van de lever-enzymen. Er zijn verschillende referentielaboratoria die kunnen ondersteunen bij het diagnosticeren (isoleren) van het RVFV. Na een incubatieperiode van 1-4 dagen en een periode van vireamie van 1-4 dagen, kunnen al vrij snel (ongeveer 10 dagen na een experimentele infectie) antilichamen worden aangetoond met verschillende immunologische technieken. Er is onder andere een specifieke ELISA en er zijn RT-PCR-technieken die voor de diagnostiek gebruikt kunnen worden. Deze zijn moderner/beter dan de CBR, HI en andere technieken.
Prevalentie van Rift valley fever
Europa
RVF is tot op heden niet op het Europese continent aangetoond.
Andere landen
RVF is voor het eerst beschreven in 1931, op basis van de symptomen bij schapen en lammeren nabij Naivasha in de Rift Valley van Kenia. Het oorzakelijke virus werd geïsoleerd na inoculatie van lammeren met serum van doodzieke schapen. RVFV is later geclassificeerd behorend tot de familie van de Buyaviridae en het genus Phlebovirus.
Men ging ervanuit dat dit virus al sinds 1911 endemisch was in deze regio van Kenia (in 1911 werd voor het eerst een uitbraak gemeld van sterfte van lammeren en schapen zonder dat men een agens kon identificeren). In 1968, ‘78/’79, en ‘97/’98 zijn grote uitbraken gemeld in Kenya, Zuid-Afrika, Zimbabwe, Zambia en op Madagaskar. In West- en Midden-Afrika is RVFV pas in 1974 aangetoond, waarbij in 1987 en 1998 grote uitbraken in Mauritanië zijn beschreven.
Andere landen (in Afrika) waar de aanwezigheid van het virus is aangetoond zijn Senegal, Mali, Guinee en Centraal Afrika. Tot 1977 is RVFV alleen gevonden in landen ten zuiden van de Sahara, echter in 1977 veroorzaakte het virus een plotseling optredende ernstige uitbraak in Egypte. Ook in 1993 en in 1997 werden uitbraken vanuit deze regio gemeld. Eind jaren ‘90 spreidde RVF zich vanuit Kenia naar Tanzania en Somalië. Direct diercontact (speciaal met uitvloeiing in welke vorm dan ook) met schapen werd beschouwd als zijnde de belangrijkste risicofactor voor een RVFV-infectie. Tijdens de laatstgenoemde uitbraak is ook voor het eerst een ander virus van de Buyaviridae-familie aangetoond: het Garissa-virus, verantwoordelijk voor septische koorts bij de mensen. Dit Orthobunyavirus is eigenlijk een afstammeling van het Ngari-virus. RVFV heeft in 2000 voor het eerst buiten het Afrikaanse continent (in Saudi Arabië en Jemen) voor een ernstige uitbraak gezorgd. Viraemische schapen en muggen zijn waarschijnlijk verantwoordelijk geweest voor deze uitbraak. De getypeerde stammen van het virus waren terug te voeren naar Kenia. Ook de 1990-uitbraak op Madagaskar was terug te voeren naar Kenia. Daar is kennelijk een belangrijk reservoir van dit virus gelokaliseerd. In oktober 2007 werd via Pro-Med nog een verdenking in Irak gemeld, die overigens niet werd bevestigd. Als tussengastheer van RVFV treden muggen op. Waakzaamheid met betrekking tot plotselinge verspreiding van RVF naar andere regio’s en eventueel richting Nederland blijft geboden. In 2017 schrijft Mroz et al.: Additionally, a subset of samples was analysed for acute infections using IgM ELISA and real-time reverse transcriptase PCR. The results indicated that the RVFV is still circulating in Egypt as about 10% of the non-immunized animals exhibited RVFV-specific antibodies (onderzoek 2013-2015).
Tegen begin juli [2018], een uitbraak van RVF, die zowel mensen als vee treft in Wajir en aanzienlijk verminderd in delen van Mandera, maar het is nog steeds aan de gang in Mandera South, Marsabit (Moyale, North Horr, Saku en delen van Laisamis sub-counties), en Isiolo (Sericho, Merti en Oldonyiro afdelingen). Alle veemarkten en slachthuizen in de getroffen gebieden blijven gesloten in een poging om de verspreiding van de ziekte te stoppen, waardoor een belangrijke bron van veehoudersinkomen wordt beperkt. Er worden nog steeds veel vaccinaties uitgevoerd en er zijn waarschuwingen verstuurd in naburige provincies.
Aanpak besmette bedrijven
Rift valley fever is een meldingsplichtige ziekte volgens artikel van de European Animal Health Law Elke verdenking van de ziekte dient te worden gemeld bij de NVWA. De aanpak van besmette bedrijven wordt uitgevoerd volgens de dan geldende draaiboeken. Er wordt over de hele wereld (o.a. bij WBVR in Lelystad, goedgekeurd door Coalition for Epidemic Preparedness Innovations (CEPI) okt.’2023) heel hard gewerkt aan de ontwikkeling van een vaccin voor in eerste instantie endemische gebieden in Oost en Sub-Sahara (Afrika). Momenteel worden additionele veiligheids- en effectiviteitsstudies uitgevoerd. Tevens wordt het vaccin voorbereidt voor een eerste evaluatie in de mens. WBVR is partner in dit project: Rift Valley fever vaccine development project Larissa.
Preventie van Rift valley fever
Voor de preventie zijn vroegtijdige melding, diagnostiek en euthanasie en ruimen van verdachte dieren van groot belang. Opstallen, mechanische ventilatie en het gebruik van insecticiden dragen bij het aan het beperken van het risico op contact met knutten. En voor mensen het dragen van shirts met lange mouwen en broeken met lange pijpen in endemische gebieden. Voor deze gebieden bestaan ook vaccinatie programma’s (zie opmerking onderaan, zie einde doc).
Attentie: Gezien de ernstige potentieel zoönotische eigenschappen van het virus kan niet genoeg benadrukt worden dat bij verdenking door alle personen die in contact komen met de dieren de nodige voorzorgsmaatregelen moeten worden genomen. Aan laboratoriumperso- neel wordt dringend geadviseerd alle lab-testen uit te voeren in absoluut insectvrije, “geïsoleerde” laboratoria.
Regelgeving
Nederlands recht
Rift valley fever is een meldingsplichtige ziekte volgens artikel 100 van de Gezondheids- en Welzijnswet voor Dieren (2022). Elke mogelijke verdenking van de ziekte dient te worden gemeld bij de NVWA.
Europees recht
De EU heeft richtlijnen opgesteld voor bestrijdingsplichtige dierziekten. Deze maatregelen zijn opgenomen in de nationale wetgeving van de aangesloten landen. De richtlijnen zijn te vinden op de website EUR-Lex van de Europese Unie.
Internationaal
Door het OIE zijn regels vastgelegd om als land of regio vrij verklaard te kunnen worden.
Websites en literatuur
Websites
- www.who.int/mediacentre/factsheets/fs207/en/
- www.cdc.gov/vhf/rvf/
- www.wageningenur.nl/nl/show/Verspreidingspotentieel-van-Rift-Valley-fever-virus-in-Nederland.htm
- www.oie.int/en/for-the-media/animal-diseases/animal-disease-information-summaries/
Literatuur
- Clements, A.C.A., Pfieffer, D.U., Martin, V., Otte, M.J. 2007. A Rift Valley Fever atlas for Africa. Prev. Vet. Med. 82, 72-82.
- Eisa, M. Obeid, H.M.A., El-Sawi, A.S.A.,1973. Rift Valley Fever in the Sudan; Results on field investigations of the first epizootic in Kosti District. Bull. Anim. Prod. Afr. 25, 343-347.
- Wood, O.L., Meegan, J.M., Morrill, J.C., Stephenson. 1993. Rift Valley Fever Virus. Chapter 44 (pg. 481-494) in Virus infections of Vertebrates, Vol. 3.: Virus infections of Ruminants, Edited by Dinter Z., Morein, B.
- Elbers, A.R. W. , Meiswinkel, R. Weezep, E. van., Sloet van Oldruitenborgh-Oosterbaan, M.M. and Kooi, E. A. 2012. Schmallenberg Virus in Culicoides spp. Biting Midges, the Netherlands, 2011. Factsheet: Emerging Infectious Diseases.
- Himeidan YE, Kweka EJ, Mahgoub MM, El Rayah el A, Ouma JO.2014. Recent outbreaks of rift valley Fever in East Africa and the middle East. Front Public Health. 2:169. doi: 10.3389/fpubh.2014.00169. Review.
- Linthicum KJ, Britch SC, Anyamba A. 2016. Rift Valley Fever: An Emerging Mosquito-Borne Disease.Annu Rev Entomol. 61:395-415.
- Rostal MK, Liang JE, Zimmermann D, Bengis R, Paweska J, Karesh WB. 2017. Rift Valley Fever: Does Wildlife Play a Role? ILAR J. 31:1-12.
- Mroz C, Gwida M, El-Ashker M, Ziegler U, Homeier-Bachmann T, Eiden M, Groschup MH. 2017. Rift Valley fever virus infections in Egyptian cattle and their prevention. Transbound Emerg Dis. 2017 Jan 24.
- Cook EAJ, Grossi-Soyster EN, de Glanville WA, Thomas LF, Kariuki S, Bronsvoort BMC, Wamae CN, LaBeaud AD, Fèvre EM. 2017. The sero-epidemiology of Rift Valley fever in people in the Lake Victoria Basin of western Kenya. PLoS Negl Trop Dis.11: e0005731
- Hartman A.2017. Rift valley Fever. Clin Lab Med. 37:285-301
- Boshra H, Lorenzo G, Busquets N, and Brun A 2011. Rift Valley Fever: Recent Insights into Pathogenesis and Prevention. J Virol. 85: 6098–6105.
Bijlage 1: Epidemiologie
RVF is vooral een aandoening die voorkomt bij schapen, runderen en in mindere mate bij geiten. Europese runderen zijn dan nog weer gevoeliger dan inheems Afrikaanse rassen. Andere rassen zijn relatief ongevoelig; paarden ontwikkelen wel antilichamen (in afwezigheid van kliniek), evenals kameelachtigen. Varkens kunnen ook wel geïnfecteerd worden, maar vertonen ook geen kliniek. Vogels hebben een natuurlijke weerstand tegen de infectie.
Ondanks intensieve onderzoekingen is het tot heden niet gelukt reservoirs van RVFV te vinden in Afrika. In het verleden dook RVF honderden kilometers verderop op, vooral na periodes van langdurige regen. Er worden ook jaarlijks incidenten gemeld van positieve sentineldieren in de westelijke kustgebieden (nat en bosrijk) van Kenia, Mozambique en oostelijk Zuid-Afrika. Introductie van RVF in een nieuw gebied gaat gepaard met een typische spreiding, gebonden aan de spreiding van de muggen. Waarschijnlijk is de transmissie van RVF dus heel vergelijkbaar met de transmissie van blauwtong, anno 2006 en 2023 in de West-Europa.
Veel onderzoek is gedaan naar de mogelijkheid van “overwintering” van het virus in arthropoden. Gezien de korte levensduur van de muggen moet dan met name gedacht worden aan een soort transovariële transmissie en men gaat er vanuit dat dit niet een heel belangrijke rol speelt.
Vele soorten muggen van de genera Aedes, Anopheles, Culex, Eretmapotides en Mansonia kunnen RVFV overbrengen, waarbij opgevallen is dat met name Culex pipens tijdens de uitbraak in Egypte een voorkeur had voor dieren in de koortsfase en op die manier verzekerd was van de opname van hoge concentraties virus. De brede range van muggensoorten die het virus kunnen overbrengen maakt introductie in de hele wereld mogelijk. Hoewel virus wel is geïsoleerd uit andere arthropoden (bijvoorbeeld Rhipicephalus sangineus-teken) is het niet gelukt ook transmissie te bewerkstelligen. Bloed en serum van geïnfecteerde dieren (en mogelijk ook vruchtwater van verwerpers) zijn belangrijke bronnen van besmetting voor mensen (slachthuispersoneel etc.).
De geografische verspreiding is vooral vanuit gebieden in de Sub-Sahara en Oost Afrika, naar met name ook in het Midden-Oosten en Azië, waar alleen in Israël en Egypte een vaccinatie-programma bestaat (zie ook Figuur 1).
Bijlage 2: Promed
Promed 23-11-07, op basis van verdenking in Kenya:
In RVF outbreaks, the vast majority of human infections result from direct or indirect contact with the blood or organs of infected animals. The virus can be transmitted to humans through the handling of animal tissue during slaughtering or butchering, assisting with animal births, conducting veterinary procedures, or from the disposal of carcasses or fetuses.
Human infections have also resulted from the bites of infected mosquitoes. Humans may also become infected with RVF by ingesting the unpasteurized or uncooked milk or meat of infected animals. Key public health measures include social mobilization, to help people who come into contact with cattle, sheep, and other animals to adopt safe handling and slaughtering practices; epidemiological measures such as active case finding; supportive clinical measures; vector control to stop the spread of disease, primarily between animals but also from animals to humans; and laboratory diagnosis capacity.
The national response to the outbreak is being managed by an inter-ministerial task force, with the participation, inter alia, of the Federal Ministry of Health and the Federal Ministry of Animal Resources and Fisheries. This task force is responsible for managing integrated action to control the spread of the disease and to decrease the impact on human and animal health. In support of the task force, state and federal ministers of health met on Tue 20 Nov 2007 to discuss the response activities and called for systematic measures to control the spread of disease in animal populations, including controls on animal movement. The WHO Eastern Mediterranean Regional Office and WHO headquarters continue to support the Sudan Federal Ministry of Health in its role as part of the national Task Force, through the provision of technical support. Continued, integrated intensive social mobilization efforts are urgently needed, using all locally available media, including television and radio channels, as well as community and religious leaders, to ensure that at-risk communities are fully aware of the measures that need to be taken to reduce the risk of human infection.
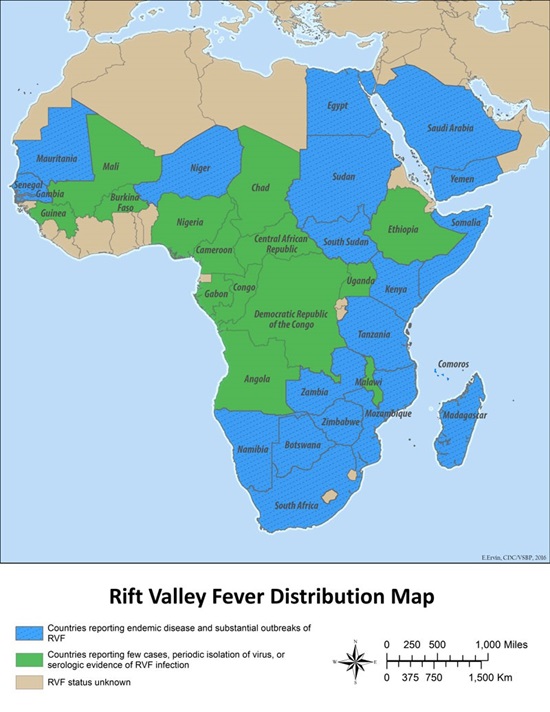
Figuur 1: Overzicht van de meest recente (2020) verspreidingsgebieden van RVF, blauw is endemisch, groen is epidemisch (bron www.OIE.int)
Bijlage 3: Update 2012
RVF vectors (05- 2010)
- Several different species of mosquito are able to act as vectors for transmission of the RVF virus. The dominant vector species varies between different regions and different species can play different roles in sustaining the transmission of the virus.
- Among animals, the RVF virus is spread primarily by the bite of infected mosquitoes, mainly the Aedes species, which can acquire the virus from feeding on infected animals. The female mosquito is also capable of transmitting the virus directly to her offspring via eggs leading to new generations of infected mosquitoes hatching from eggs. This accounts for the continued presence of the RVF virus in enzootic foci and provides the virus with a sustainable mechanism of existence as the eggs of these mosquitoes can survive for several years in dry conditions. During periods of heavy rainfall, larval habitats frequently become flooded enabling the eggs to hatch and the mosquito population to rapidly increase, spreading the virus to the animals on which they feed.
- There is also a potential for epizootics and associated human epidemics to spread to areas that were previously unaffected. This has occurred when infected animals have introduced the virus into areas where vectors were present and is a particular concern. When uninfected Aedes and other species of mosquitoes feed on infected animals, a small outbreak can quickly be amplified through the transmission of the virus to other animals on which they subsequently feed.
- SBV epidemy was mainly caused by Culicoides spp.: Throughout September and early October 2011, Culicoides spp. biting midges were trapped almost daily at a dairy in the municipality of Ermelo (eastern Netherlands) by various methods, including the standard Onderstepoort-type blacklight trap. In addition, during several days in August and September 2011, Culicoides spp. biting midges were trapped near sheep flocks in the municipalities of Bilthoven (central Netherlands) and Midden-Drenthe (northeastern Netherlands) by using the Onderstepoort-type trap and a drop-tent cage. Captured midges were stored in 70% ethanol (Elberse et al., 2012).
These vectors are most probably the same as those responsible for the BTV outbreaks and distinguishing from the RVF-vectors.
Bovenstaand overzicht van de meest besmette gebieden (Kenya en Mozambique, Holzhauer. persoonlijke mededeling) en andere endemische gebieden.
Prevention and control
Controlling RVF in animals
Outbreaks of RVF in animals can be prevented by a sustained programme of animal vaccination. Both modified live attenuated virus and inactivated virus vaccines have been developed for veterinary use. Only 1 dose of the live vaccine is required to provide long-term immunity but this vaccine may result in spontaneous abortion if given to pregnant animals. The inactivated virus vaccine does not have this side effect, but multiple doses are required in order to provide protection which may prove problematic in endemic areas.
Animal immunization must be implemented prior to an outbreak if an epizootic is to be prevented. Once an outbreak has occurred animal vaccination should NOT be implemented because there is a high risk of intensifying the outbreak. During mass animal vaccination campaigns, animal health workers may, inadvertently, transmit the virus through the use of multi-dose vials and the re-use of needles and syringes. If some of the animals in the herd are already infected and viraemic (although not yet displaying obvious signs of illness), the virus will be transmitted among the herd, and the outbreak will be amplified.
Restricting or banning the movement of livestock may be effective in slowing the expansion of the virus from infected to uninfected areas.
As outbreaks of RVF in animals precede human cases, the establishment of an active animal health surveillance system to detect new cases is essential in providing early warning for veterinary and human public health authorities.